سرطان معده و راه های مدیریت و درمان آن
سرطان معده دومین عامل شایع مرگ و میر ناشی از سرطان در جهان است که اپیدمیولوژی آن در دهه های اخیر تغییر کرده است. روند کاهش مداوم در میزان بروز سرطان معده، تأثیر افزایش استانداردهای بهداشت، تغذیه آگاهانه و ریشه کنی هلیکوباکتر پیلوری است که همه اینها باهم پیشگیری اولیه را تشکیل می دهند. پیشگیری از سرطان معده همچنان یک اولویت است. با این حال، بیماران با خطر بالاتر باید برای تشخیص زودهنگام و پیشگیری از شیمی درمانی غربالگری شوند. برداشتن تومور توسط جراحی همراه با لنفادنکتومی، استاندارد طلایی در درمان سرطان معده است. این مقاله به طور خلاصه مهمترین جنبه های سرطان معده را که شامل اپیدمیولوژی، عوامل خطر، طبقه بندی، تشخیص، پیشگیری و درمان است، مورد بررسی قرار می دهد.
اپيدميولوژي
کارسینوم معده (GC) چهارمین بدخیمی شایع در سراسر جهان است (989600 مورد جدید در سال در سال 2008) و دومین علت مرگ (738000 مرگ در سال) از همه بدخیمی ها در سراسر جهان است. این بیماری در مراحل پیشرفته علامت دار می شود. نرخ بقای پنج ساله در ژاپن نسبتاً خوب است، جایی که به 90% میرسد. در کشورهای اروپایی، میزان بقا از 10% تا 30% متغیر است. بیش از 50 درصد موارد جدید در کشورهای در حال توسعه رخ می دهد. یک تنوع 15 تا 20 برابری در بین جمعیت های پرخطر و کم خطر وجود دارد.
مناطق پرخطر عبارتند از شرق آسیا (چین و ژاپن)، اروپای شرقی، آمریکای مرکزی و جنوبی. مناطق کم خطر عبارتند از جنوب آسیا، شمال و شرق آفریقا، آمریکای شمالی، استرالیا و نیوزلند. کاهش مداوم در میزان بروز GC در چند دهه اخیر در سراسر جهان مشاهده شده است. این روند به ویژه در مورد بیماران جوان مبتلا به GC غیر درگیری کاردیا، اسپورادیک و روده ای، همانطور که در تجزیه و تحلیل ژاپنی گزارش شده است، اعمال می شود. از سوی دیگر، مطالعه آمریکایی زیرجمعیتهای نژادی و سنی و همچنین زیرگروه آناتومیک سرطان معده را از هم متمایز میکند. با این وجود، کاهش عمومی بروز GC ممکن است با استانداردهای بالاتر بهداشت، بهبود مصرف مواد غذایی، مصرف زیاد میوهها و سبزیجات تازه، و ریشهکنی هلیکوباکتر پیلوری (H. pylori) مرتبط باشد.
نتیجه گیری های مربوط به اپیدمیولوژی GC :
- GCشناسایی شده در مرحله > T1N0 پیش آگهی بدی دارد.
- بروز GC از نظر جغرافیایی متفاوت است.
- در چند دهه اخیر، بروز GC به طور پیوسته کاهش یافته است.
عوامل خطر و پیشگیری از سرطان معده
سرطان معده در نتیجه ترکیبی از عوامل محیطی و تجمع تغییرات ژنتیکی خاص ایجاد می شود. با وجود روند کاهشی در سراسر جهان، پیشگیری از GC باید یک اولویت باقی بماند. پیشگیری اولیه شامل رژیم غذایی سالم، درمان های ضد باکتری H.pylori و پیشگیری از شیمی درمانی و غربالگری برای تشخیص زودهنگام میباشد. عوامل غذایی تأثیر مهمی بر سرطان زایی معده دارند، به ویژه در موارد آدنوکارسینوم روده.
عادات غذایی سالم، یعنی مصرف زیاد میوهها و سبزیجات تازه، رژیم مدیترانهای، رژیم کم سدیم، کاهش مواد غذایی حاوی نکه دارنده و نمک، گوشت قرمز و پرخاصیت، نوشیدن مقدار معقولی از الکل و حفظ وزن مناسب ممکن است با کاهش ریسک سرطان معده مرتبط باشد.
نقش محافظتی میوه های تازه و سبزی های سبز تیره، سبز روشن و زرد سرشار از کاروتن B، ویتامین C، E و فولات به شدت مورد تاکید قرار گرفته است، احتمالاً به دلیل اثر آنتی اکسیدانی آنها. به نظر می رسد که B کاروتن اصلی ترین کاهش دهنده خطر GCباشد به نظر می رسد تأثیر مفید رژیم غذایی غنی از ویتامین در موارد کمبود زودرس فولات و سلنیوم قابل توجه باشد. با این وجود، نتایج مطالعات مختلف در مورد خواص ضد سرطانی کاروتنوئیدها، توکوفرول ها و رتینوئیدها همیشه منسجم نیستند. بنابراین این موضوع مستلزم بررسی های بیشتر است. بسیاری از مطالعات تأیید کرده اند که سیگار کشیدن خطر ابتلا به GC ، هر دو نوع کاردیا و غیرکاردیا را افزایش می دهد.
همچنین نشان داده شده است که خطر GC در مردان سیگاری 60 درصد و در زنان سیگاری 20 درصد نسبت به افراد غیر سیگاری افزایش می یابد. خطر GC در سیگاریهای سابق در مقایسه با سیگاریهایی ک گاه به گاه سیگار مصرف میکنند کمتر است و سیگاریهایی که مصرف سیگار بیشتری دارند (بیش از 20 نخ در روز) در معرض خطر بالای GC هستند. مصرف الکل همچنین مستعد GC است. ارتباط بین سوء مصرف الکل و سرطان قسمت کاردیا ی معده گزارش شده است. مشخص شده است که GC با وضعیت اجتماعی-اقتصادی رابطه معکوس دارد، به طوری که موقعیت اجتماعی-اقتصادی بالا با کاهش خطر ابتلا به GC، به ویژه زیرگروه های کاردیا و روده ای همراه است.
مشاغلی که بیشتر در معرض خطر GC هستند:
کارکنان معدن، ماهیگیران، اپراتورهای ماشینآلات، پرستاران، آشپزها، لباسشوییها و خشکشوییها هستند، زیرا در معرض ریسک های شغلی اصلی شامل گرد و غبار، اکسیدهای نیتروژن، ترکیبات N-nitroso و تشعشعات هستند. مارشال و وارن ارتباط بین هلیکوباکتر پیلوری و التهاب معده را در سال 1982 کشف کردند. در سال 1994، هلیکوباکتر پیلوری توسط آژانس بین المللی تحقیقات سرطان به عنوان یک سرطان زا کلاس I طبقه بندی شد.
ابتلا به هلیکوباکتر پیلوری یکی از علل شایع مشکلات گوارشی است، اما تنها تعداد کمی از بیماران مبتلا به بیماری شدیدی مانند زخم معده (10-15٪) یا GC (1٪ - 3٪) مبتلا می شوند. در جمعیت عمومی، عفونت هلیکوباکتر پیلوری به 60% می رسد، اما در بیماران مبتلا به GC، شایع تر است (84%) یا حتی اجتناب ناپذیر است. ارتباط بین عفونت هلیکوباکتر پیلوری و GC در سنین کمتر (کمتر از 40 سال) ارتباط بیشتری دارد است، در هر دو نوع روده ای و منتشرو غیرکاردیایی،مورد دوم در سرطان معده با شروع زودرس (EOGC) شایع تر است.
بدون شک، همبستگی قوی بین عفونت هلیکوباکتر پیلوری و GC یک هدف برای مداخله است. دستورالعمل Maastricht III برای درمان عفونت ،درمان را در موارد زیر توصیه میکند:
- در بیماری های زخم معده،
- لنفوم های بافت لنفاوی مرتبط با مخاط،
- گاستریت آتروفیک،
- بیماران پس از برداشتن قسمت GC،
- وجود بستگان درجه اول مبتلا بیماران با GC،
- بیماران مبتلا به کم خونی ناشی از فقر آهن غیر قابل توضیح، -بیماران مبتلا به پورپورای ترومبوسیتوپنی ایدیوپاتیک،
- بیمارانی که به داروهای ضد التهابی غیراستروئیدی طولانی مدت (NSAIDs) نیاز دارند
- و در بیمارانی که مایل به درمان هستند.
درمان خط اول ریشه کنی هلیکوباکتر پیلوری بر مهارکننده های پمپ پروتون و ترکیب دو آنتی بیوتیک مانند آموکسی سیلین، کلاریترومایسین یا مترونیدازول متکی است. اگر اولین درمان موفق نشد، درمان خط دوم پیشنهادی بیسموت، مهارکننده پمپ پروتون، تتراسایکلین و مترونیدازول است. ویروس اپشتین بار (EBV) یک ویروس انسانی است که برای آن نقش علتی در سرطانزایی معده پیشنهاد شده است.
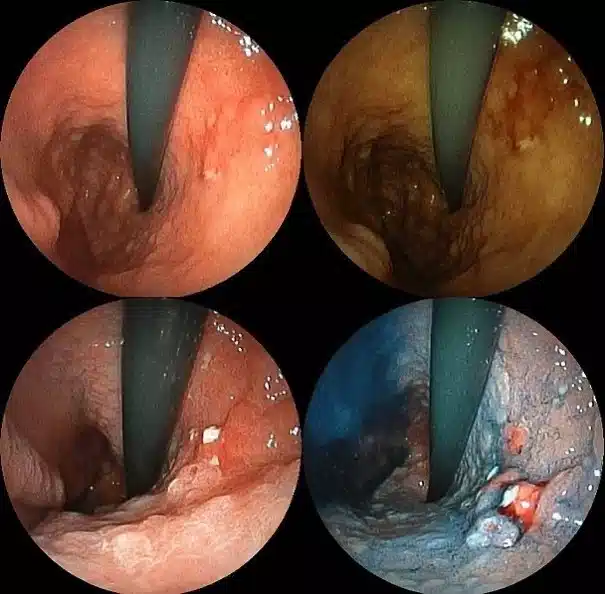
ارتباط بین EBV و سرطانزایی از 4% در چین، 7.7% در فرانسه، 8.1% در روسیه، 12.5% در لهستان، به 17.9 درصد در آلمان متغیر است. EBV در بیوپسی های سرطان معده نشان می دهد که تومور با تکثیر یک سلول آلوده تشکیل شده است. EBV در باقیمانده معده پس از جراحی کارسینوم (27%) بیشتر از معده دست نخورده است.
در مطالعه ای نشان داده شده است که مصرف کنندگان آسپرین و NSAID در معرض کاهش خطر GC هستند. از طرف دیگر، عوارض جانبی این موارد خونریزی، سوراخ شدن معده یا انسداد خروجی معده است، و بنابراین، این داروها برای بیماران با سابقه بیماری های گوارشی توصیه نمی شود. در اواخر دهه 1990، اشتیاق دائمی نسبت به NSAID های انتخابی COX-2 وجود داشت، اما اندکی بعد، آنها به افزایش خطر سکته قلبی کنار گذاشته شدند. شجرنامه خانوادگی GC قرنها گزارش شده است و نمونهی معروف آن خانواده ناپلئون بناپارت است. در سال 1998، جهشهای کوتاهکننده CDH1 در رده زایی سه خانواده مائوری نیوزلند انتشار GC توصیف شدند. به طور کلی، خطر ابتلا به GC در افراد با سابقه خانوادگی GC 1.5-3 برابر افزایش می یابد.
چاقی یک عامل خطر برای کارسینوم کاردیای معده است. عوامل خطر کمتر شایع عبارتند از کم خونی پرنیشیوز و گروه خونی A. آندوسکوپی حساسترین و اختصاصیترین روش غربالگری تشخیصی است. با این حال، غربالگری انبوه برای تشخیص زودهنگام GC گران است و بنابراین، فقط در مناطق با شیوع بالا مانند آسیای شرقی توصیه میشود و در مناطق کمتر شایع بیمعنی است. علاوه بر این، غربالگری با آندوسکوپی باید یک تا دو بار در سال در بیمارانی که در معرض خطر بالاتر GC هستند (سابقه GC در خانواده، پولیپوز آدنوماتوز خانوادگی، سندرم Li-Fraumeni، جهشهای BRCA2، سندرم ارثی غیر پولیپوز سرطان روده بزرگ، پوتز-جگرز سندرم، و بیماری منتریه، جراحی قبلی معده، پولیپ معده) انجام شود.
به طور خلاصه در مورد عوامل خطر و پیشگیری از سرطان معده:
تشخیص زودهنگام عوامل خطر GC قابل تغییر و غیرقابل تغییر در پیشگیری اولیه حیاتی است.
عوامل خطر قابل تغییر در بروز سرطان معده به شرح زیر است:
- وابسته به بیمار: حفظ رژیم غذایی متعادل، مصرف متوسط و معقول الکل، ترک سیگار و حفظ وزن طبیعی.
- وابسته به پزشک: ریشه کنی هلیکوباکتر پیلوری با در نظر گرفتن NSAID ها.
عوامل خطر غیرقابل تغییر GC عبارتند از مواجهه شغلی، سابقه خانوادگی GC، بیماری های همراه و سابقه گاسترکتومی نسبی.
طبقه بندی سرطان معده
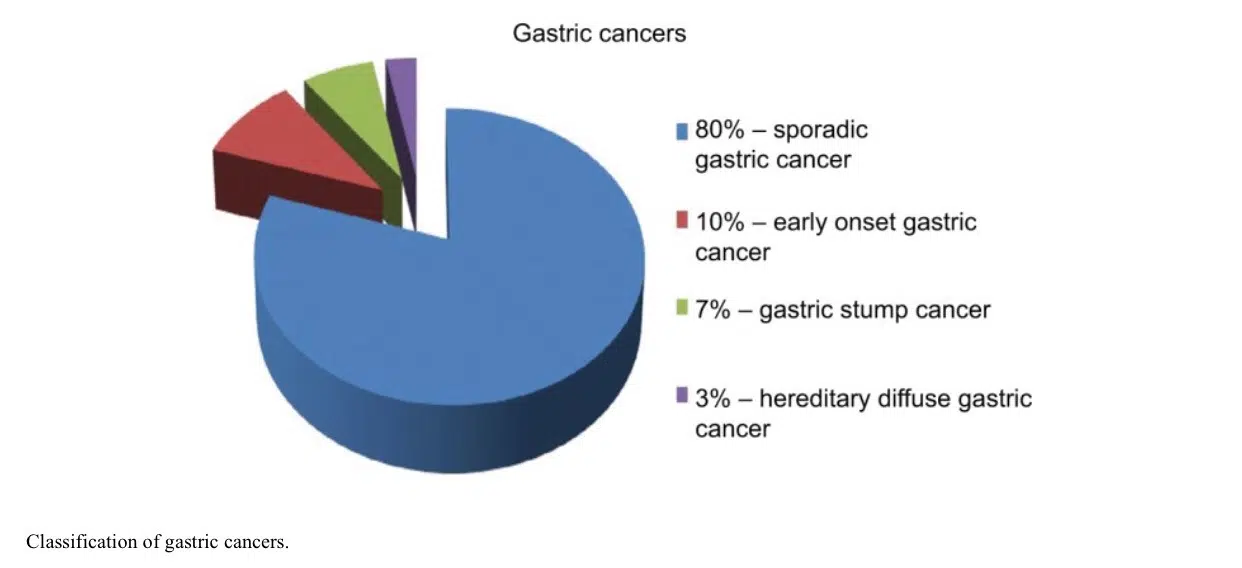
سرطان معده پراکنده (Sporadic)
اکثر GC به صورت پراکنده رخ می دهد و عمدتا افراد بالای 45 سال را تحت تاثیر قرار می دهد. این کارسینوم ها به عنوان "سرطان های پراکنده معده" (SGCs) نامیده می شوند (شکل 1). آنها معمولاً به دلیل همزمانی بسیاری از عوامل محیطی ایجاد می شوند. این نوع از سرطان معده در سن 60 تا 80 سالگی رخ می دهند و مردان دو برابر بیشتر تحت تأثیر قرار می گیرند.
سرطان معده با شروع زودرس( EOGC )
به عنوان GC قبل از 45 سالگی تعریف می شود و حدود 10٪ از GCها را در بر می گیرد (شکل 1). اغلب در زنان مشاهده می شود، احتمالاً به دلیل عوامل هورمونی. پاتوژنز [56،59-62]SGC و EOGC در سطح مولکولی نیز متفاوت است.
سرطان stump معده
سرطان استامپ معده (GSC) یک زیرگروه جداگانه از GC است که به عنوان سرطانی تعریف میشود که حداقل 5 سال پس از جراحی زخم معده در بقایای معده رخ میدهد و مردان بیشتر از زنان مستعد ابتلا به آن هستند. گاسترکتومی یک عامل خطر ثابت برای GSC است، حتی مدت طولانی پس از جراحی اولیه. پس از 15 سال پس از گاسترکتومی، خطر GSC در مقایسه با جمعیت سالم، چهار تا هفت برابر افزایش یافته است. عفونت EBV اغلب در بقایای معده تحت جراحی ناشی از زخم بیشتر از معده دست نخورده است. ویروس ممکن است با پروتئین p53 تعامل داشته باشد. [70]GSC ها معمولاً با ضایعات پیش ساز کاملاً مشخص و عمدتاً توسط دیسپلازی پیش می آیند و بنابراین اسکرینینگ آندوسکوپی با بیوپسی های متعدد گاستروآنتروستوما توصیه می شود.
سرطان معده منتشر ارثی (HDGC)
اکثر موارد GCها به صورت پراکنده ظاهر می شوند، اما در 5٪ تا 10٪ موارد، شجره ی خانوادگی مشاهده می شود. جهشهای زایا در ژن CDH1 هستند که E-cadherin را کد میکنند. این بیماری با شرایط اتوزومال غالب است که باعث ایجاد GC منتشر و با تمایز ضعیف می شوند که به دیواره معده نفوذ می کند و باعث ضخیم شدن دیواره بدون تشکیل توده مشخص می شود.
طبقه بندی پاتولوژیک
طبق دستورالعمل های سازمان بهداشت جهانی، GC را می توان به عنوان آدنوکارسینوم، کارسینوم سلول signet ring و کارسینوم تمایز نیافته طبقه بندی کرد. با این حال، به اندازه طبقه بندی لورن که دو زیرگروه اصلی GC را متمایز می کند، استفاده نمی شود. طبقه بندی لورن شامل تفاوت های میکروسکوپی و ماکروسکوپی است. گاستریت آتروفیک و متاپلازی روده ای، در حالی که انواع منتشر از مخاط طبیعی معده منشأ می گیرند. نسبت انواع روده ای و منتشر بین کشورها و قاره ها متفاوت است. در کشورهای اروپایی، نوع روده ای در حال حاضر شایع تر است. بیشتر در ناحیه دیستال معده، در مناطق پرخطر رخ می دهد، و اغلب قبل از آن یک ضایعه پیش سرطانی طولانی مدت رخ می دهد.وسعت رزکسیون جراحی به زیرگروه بافت شناسی GCهای لورن بستگی دارد.
نتیجه گیری مربوط به طبقه بندی پاتولوژیک :
GC بیشتر به دو زیر گروه تقسیم می شود: روده ای و منتشر. -میزان برداشتن جراحی به نتیجه هیستوپاتولوژیک بستگی دارد.
درمان سرطان معده
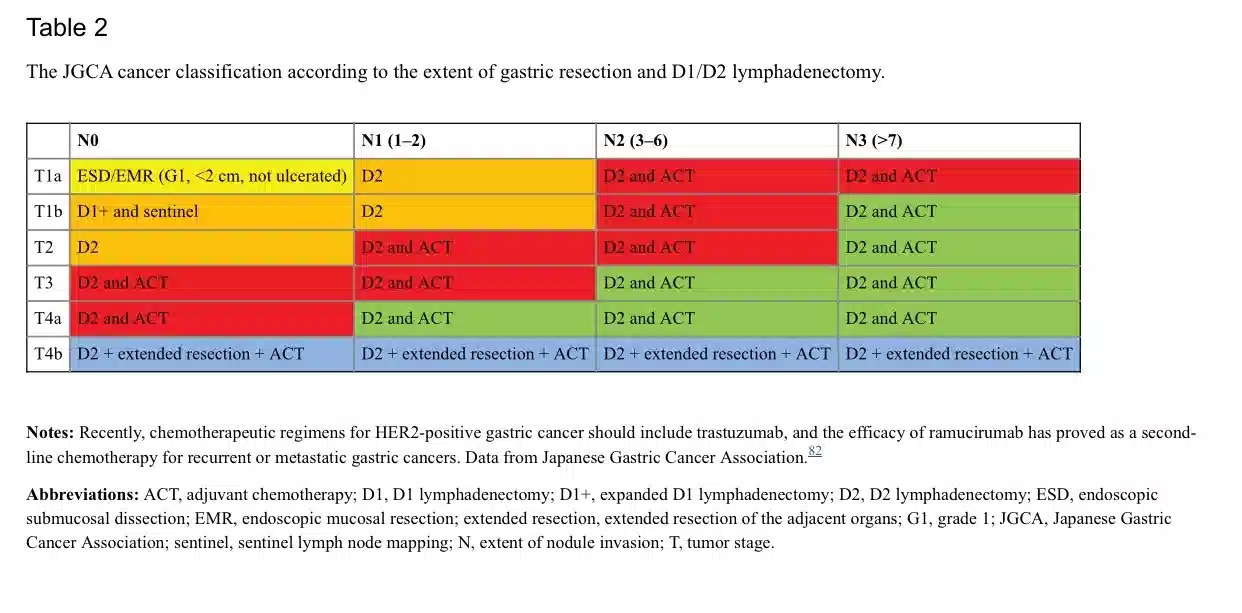
یک رویکرد چند رشته ای برای برنامه ریزی درمان GC اجباری است. تیم چند رشته ای (MDT) باید حداقل شامل یک جراح، پاتولوژیست، متخصص گوارش، انکولوژیست پزشکی و رادیولوژیست باشد. در صورت هدف درمانی، جراحی شامل برداشتن کامل با لنفادنکتومی استاندارد D2 است. 80 در سال 1998، انجمن سرطان معده ژاپن (JGCA) ) لنفادنکتومی منطقه ای را بر اساس محل تومور و درناژ گره منطقه ای مربوطه استاندارد میدانست. شانزده ایستگاه غدد لنفاوی مختلف در اطراف معده شناسایی شده است. ایستگاه های غدد لنفاوی در امتداد انحنای کوچک (ایستگاه های 1، 3 و 5) و انحنای بزرگ (ایستگاه های 2، 4 و 6) معده به عنوان N1 گروه بندی شده اند. گره های امتداد شریان معده چپ (ایستگاه 7)، شریان کبدی مشترک (ایستگاه 8)، شریان سلیاک (ایستگاه 9) و شریان طحال (ایستگاه 10 و 11) به عنوان N2 گروه بندی شده اند. گروه N3 غدد لنفاوی را در امتداد رباط کبدی دوازدهه (ایستگاه 12)، در محل خلفی پانکراس (ایستگاه 13) و در ریشه مزانتر (ایستگاه 14) در بر گرفته است. در نهایت، غدد لنفاوی اطراف شریان کولیک میانی (ایستگاه 15) و غدد لنفاوی پاراازوفاژیال تحتانی و لنف دیافراگمی (ایستگاه 16) به عنوان N4 گروهبندی شدهاند.
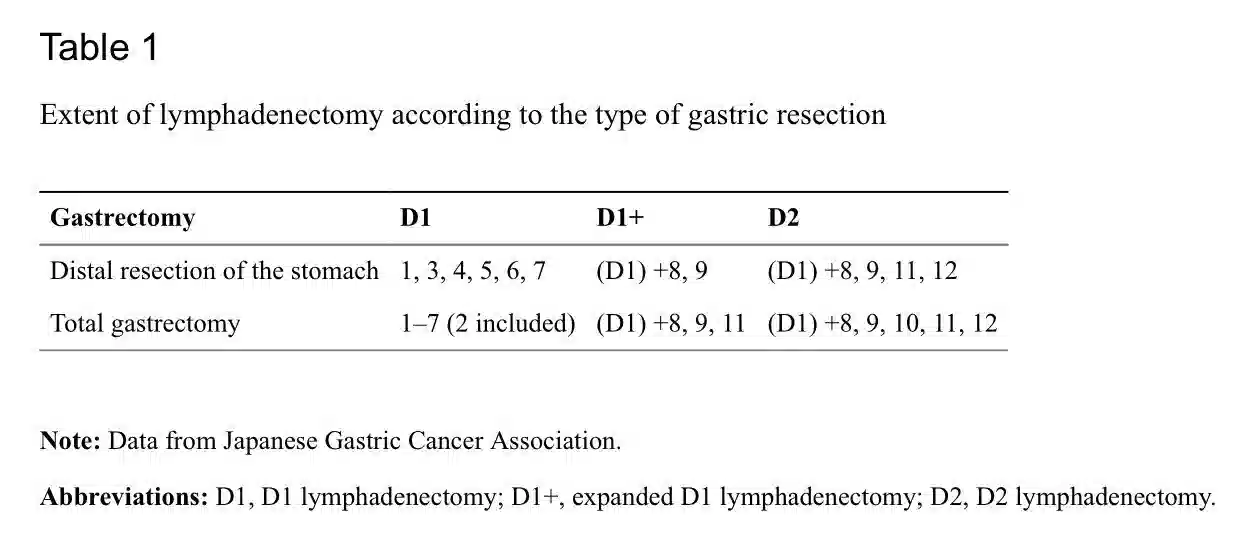
D1,D2,D3 نامهایی هستند که به روشهایی که به محدوده لنفادنکتومی.81 با این حال، ویرایش هفتم طبقه بندی TNM و نسخه جدیدی از سرطان معده طبقه بندی JGCA، تعاریف لنفادنکتومی D1/D2 را با توجه به وسعت برداشتن معده تغییر داد (جدول 1).
(Endoscopic mucosal resection )EMRدر درمان اولیه GC (T1aN0M0) و در نئوپلازی داخل اپیتلیال میتواند همان اثر برداشتن جراحی سنتی را داشته باشد. اسپلنکتومی تنها در مورد نفوذ مستقیم سرطان به ناف طحال قابل قبول است.تومورهای پیشرفته معده با متاستازهای دور معمولا غیر قابل درمان هستند. با این حال، این به مواردی که متاستاز کبدی منفرد یا تهاجم ندول های صفاقی دارند مربوط نمی شود. برای بیماران GC صعب العلاج، درمان با هدف تسکینی ممکن است کیفیت زندگی را بهبود بخشد، اما در بیماران بدون علامت توصیه نمی شود. توصیه های درمانی JGCA (ویرایش چهارم از سال 2014) در جدول۲ ارائه شده است.
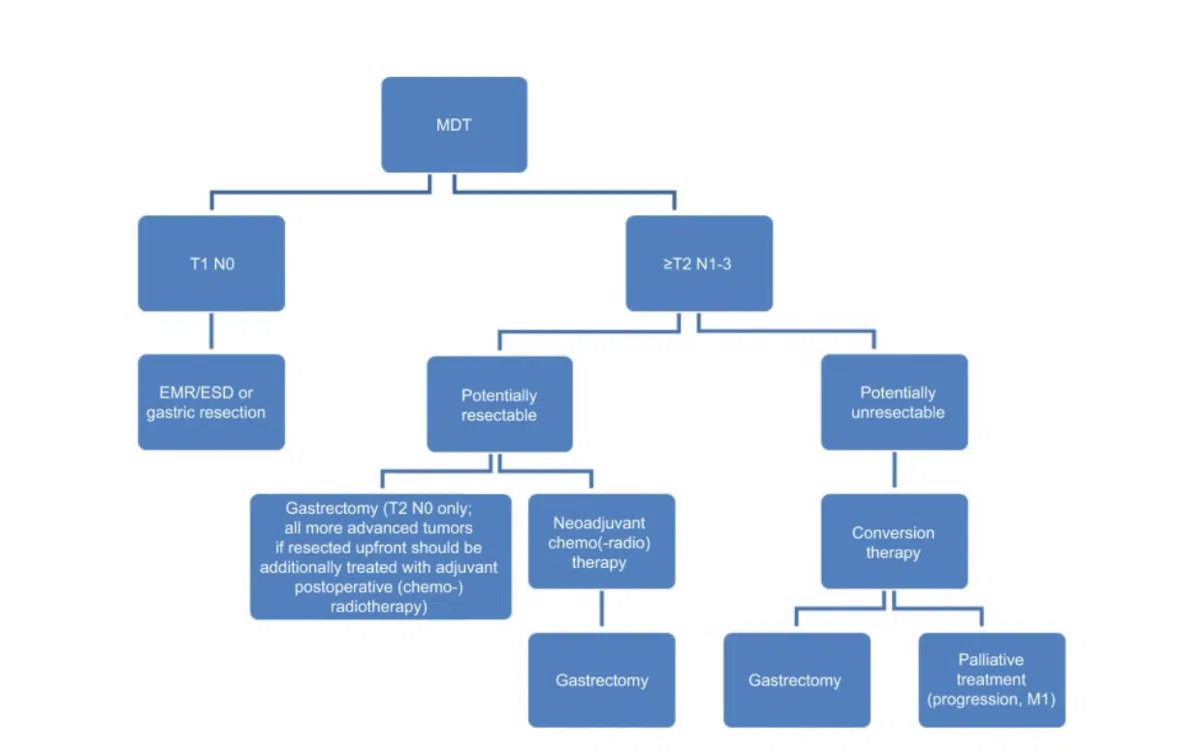
بروز بالای متاستازهای دوردست و عود موضعی پس از آن، راه را برای درمان سیستمیک و اخیراً در درمان نئوادجوانت هموار کرده است. درمان گسترده ممکن است شامل شیمی درمانی، پرتودرمانی یا ایمونوتراپی، به تنهایی یا ترکیبی باشد. مطالعات اخیر برتری درمان نئوادجوانت همراه با جراحی را بر جراحی به تنهایی، با نرخ بدون پیشرفت 5 ساله در 23% تا 36% نشان داده است.
در بیماران مبتلا به متاستاز، اما در وضعیت عمومی خوب، جراحی توصیه می شود. در مورد بیماران با وضعیت عملکرد ضعیف، تنها درمان حمایتی توصیه میشود. الگوریتم مدیریت برای بیمارانی که وضعیت عمومی خوبی دارند بدون متاستازهای دوردست (M0) در شکل نشان داده شده است.
شیمی درمانی
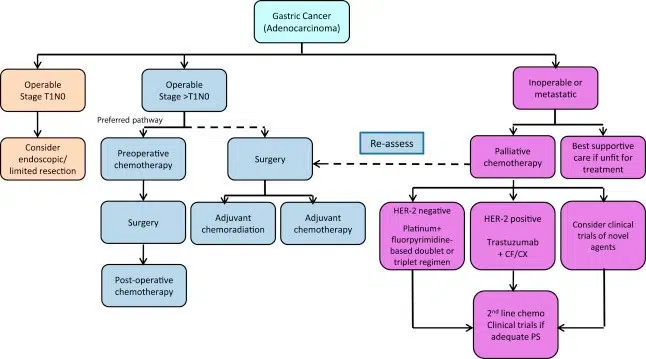
دو کارآزمایی تصادفیسازی شده بهبودی را در بقای کلی در بیمارانی که شیمیدرمانی بعد از عمل دریافت میکنند، نشان دادهاند. بنابراین، چنین درمانی به طور معمول در اروپا انجام میشود و شامل سه دوره شیمیدرمانی قبل از جراحی و سه دوره بعد از جراحی است.
پرتودرمانی نئوادجوانت
نتایج کارآزمایی INT 0116 اثربخشی پرتودرمانی و شیمی درمانی کمکی را در مقایسه با جراحی به تنهایی نشان داده است. مشاهدات سه ساله بهبود 11 درصدی را در بقای کلی پس از درمان ترکیبی با میانگین بقای 36 ماه تنها با 27 ماه بقا پس از عمل جراحی به تنهایی مقایسه شده است. میانگین زمان بقای بدون عود در گروه شیمی درمانی 30 ماه و در گروه جراحی به تنهایی 19 ماه بوده است.
اگرچه رادیوتراپی و شیمیدرمانی ادجوانت در ایالات متحده توصیه میشود، اما در کشورهای اروپایی، درمان به مواردی با لنفادنکتومی غیربهینه (برداشتن کمتر از 15 غدد لنفاوی) یا برداشتن میکروسکوپی غیرمستقیم (R1) معده محدود شده است. شیمی رادیوتراپی پس از لنفادنکتومی D1 بروز عود موضعی را کاهش می دهد و بقای بیماران را بهبود می بخشد. نتایج شیمیدرمانی حین عمل در بیماران مبتلا به GC و اتصالات معده به مری امیدوارکننده است. بهبود آماری معنیداری در بقای کلی و بقای بدون پیشرفت در 36 درصد بیماران تحت شیمیدرمانی قبل از عمل در مقایسه با 23 درصد پس از عمل مشاهده شده است. بنابراین، شیمی درمانی بعد از عمل به همراه جراحی رادیکال به عنوان یک درمان استاندارد برای تومورهای پیشرفته موضعی توصیه شده است. ترکیبی از داروها بهطور سنتی بر پایه دوتایی پلاتین-فلوروپیریمیدین است، اما افزودن آنتراسایکلین سودمند است. رایجترین پروتکلهای مورد استفاده عبارتند از ECF (اپی روبیسین، سیس پلاتین، 5-FU)، ECX (اپی روبیسین، سیس پلاتین)، EOF (اپی روبیسین، اگزالیپلاتین، 5-FU)، و EOX (اپی روبیسین، اگزالیپلاتین، کپسیتابین). از طرف دیگر، بیماران شیمی درمانی ممکن است با رژیم های مبتنی بر تاکسان یا irinotecan/5-fluorouracil درمان شوند.
درمان خط دوم مبتنی بر ایرینوتکان، دوستاکسل و پاکلیتاکسل است. با این حال، در صورت پیشرفت دیرهنگام بیماری پس از شیمی درمانی خط اول (بعد از 3 ماه)، ممکن است استفاده مجدد از همان داروها مفید باشد.
علیرغم بهبود در بقای کلی پس از شیمی درمانی نئوادجوانت، وقوع بالای عود هنوز مشاهده می شود. بنابراین، افزودن پرتودرمانی در شرایط قبل از عمل ممکن است مفید باشد. رادیوتراپی به خوبی تحمل می شود، قابلیت برداشتن تومور را بهبود می بخشد و فراوانی عوارض جراحی را افزایش نمی دهد. در حال حاضر، رادیو-شیمی درمانی ادجوانت در بیماران مبتلا به سرطان لوکو-منطقه ای پیشرفته محل تلاقی معده به مری (T2N1-3M0 یا T3N0-3M0) توصیه می شود.
رادیوتراپی تسکینی(Palliative)
رادیوتراپی در موارد GC غیرقابل برداشت همراه با کم خونی و/یا در موارد با انسداد پیلور یا کاردیا استفاده می شود. دوز 30 Gy در 10 می تواند هم در کاهش خونریزی و هم در بهبود عبور غذا موثر باشد. این اثر معمولا کوتاه است (3 تا 6 ماه)، اما یک گزینه درمانی آسان است.
درمان سرطان معده در موقعیت متاستاتیک
در مقایسه با درمان علامتی، شیمی درمانی تسکینی برای بیماران مبتلا به GC غیرقابل عمل، بقا را طولانی کرده و کیفیت آن را بهبود می بخشد. در سال 2010، سازمان غذا و داروی ایالات متحده "تراستوزوماب"، یک آنتی بادی مونوکلونال که با گیرنده HER2 تداخل دارد، برای درمان GC محلی پیشرفته و متاستاتیک تایید کرد. به دنبال نتایج کارآزمایی ToGA، "تراستوزوماب" در ترکیب با کپسیتابین یا 5-FU و سیس پلاتین اکنون استاندارد مراقبت برای GCs HER2 مثبت است.
شیمیدرمانیهای خط دوم مبتنی بر رژیمهایی با تاکسان (دوستاکسل، پاکلیتاکسل)، یا ایرینوتکان، یا راموسیروماب بهعنوان داروی منفرد یا در ترکیب با پاکلیتاکسل است. راموسیروماب آنتی بادی مونوکلونال گیرنده ۲ فاکتور رشد اندوتلیال ضد عروقی است که در مقایسه با شیمیدرمانی سیتوتوکسیک در خط دوم با افزایش بقا بیمار همراه است. راموسیروماب علاوه بر پاکلیتاکسل در مقایسه با پاکلیتاکسل به تنهایی با افزایش بقای بیمار را بیشتر میکند. با این حال، شیمی درمانی ممکن است فقط در بیماران با وضعیت عملکرد خوب (PS 0-1) مورد استفاده قرار گیرد. جراحی Cytoreductive به همراه شیمی درمانی داخل صفاقی هیپرترمیک، بقا را در گروهی از بیماران انتخاب شده با کارسینوماتوز صفاقی محدود با منشاء معده بهبود می بخشد (شاخص سرطان صفاق <12).
به طور خلاصه در درمان GC:
- محدوده عمل بستگی به مرحله بیماری دارد و در توصیه های سال 2010 توضیح داده شده است.
- درمان سیستماتیک نرخ بقای طولانی مدت و بدون پیشرفت را در مقایسه با درمان جراحی به تنهایی بهبود می بخشد.
- شیمی درمانی تسکینی در بیماران مبتلا به سرطان معده غیرقابل عمل باعث افزایش طول عمر و بهبود کیفیت زندگی می شود.
نتیجه گیری
GC یک بیماری بدخیم با پیش آگهی طولانی مدت و به طور کلی ضعیف است. اکثر GCها زیرگروه های پراکنده هستند که به شدت با عوامل خطر محیطی مرتبط هستند. در دهههای اخیر، مکانیسمهای سرطانزایی معده مشخص شده است که منجر به پیشگیری اولیه و ثانویه مانند سبک زندگی سالم و ریشهکنی هلیکوباکتر پیلوری شده است. در نتیجه، بروز سرطان معده شروع به کاهش کرده است. این کاهش به زیرگروه های GC که ناشی از استعداد ژنتیکی یا بیماری های همراه است مربوط نمی شود. با این وجود، برنامه غربالکری با آندوسکوپی برای غربالگری گروهی از بیماران با بالاترین خطر GC توصیه می شود.
هر بیمار مبتلا به GC باید طبق برنامه فردی که توسط MDT انجام شده است، درمان شود.
استراتژی برنامه ریزی باید این موارد را در نظر بگیرد:
- مرحله تومور،
- قصد درمان،
- وضعیت عملکرد بیمار و
- امکانات فنی.
به طور کلی، به نظر می رسد سودمندترین روش جراحی همراه با شیمی درمانی و رادیوتراپی باشد.
اين مقاله توسط دانشجويان پزشكي سيد مصطفي زماني و عرفان باروتچي گردآوري و صحت علمي آن مورد تائيد قرار گرفت.