آرتریت روماتوئید چیست؟
آرتریت روماتوئید (RA) یک اختلال خود ایمنی مفاصل است که با آرتریت التهابی و همچنین درگیری خارج مفصلی مشخص می شود. معمولاً چندین مفاصل هر دو دست را درگیر میکند و سفتی صبحگاهی ممکن است چند ساعت طول بکشد. این فعالیت ارزیابی و مدیریت آرتریت روماتوئید را توصیف می کند و نقش تیم بین حرفه ای را در بهبود مراقبت از بیماران مبتلا به این بیماری بررسی می کند.
آرتریت روماتوئید چیست؟
آرتریت روماتوئید (RA) یک بیماری خودایمنی سیستمیک است که با آرتریت التهابی و درگیری خارج مفصلی مشخص می شود. این بیماری یک اختلال التهابی مزمن با علت ناشناخته است که عمدتاً مفاصل سینوویال را درگیر می کند.
معمولاً در مفاصل کوچک محیطی شروع میشود، اغلب متقارن است و در صورت عدم درمان، به درگیر شدن مفاصل پروگزیمال پیشرفت میکند. التهاب مفصل به مرور زمان منجر به تخریب مفصل با فرسایش غضروف و استخوان می شود. RA با طول مدت علائم کمتر از شش ماه به عنوان RA اولیه تعریف می شود، و زمانی که علائم بیش از شش ماه وجود داشته باشد، به عنوان RA ایجاد شده (Established)تعریف می شود. هیچ آزمایش آزمایشگاهی پاتوگنومونیک برای آرتریت روماتوئید وجود ندارد که تشخیص این بیماری را چالش برانگیز می کند. یک رویکرد بالینی دقیق و جامع برای تشخیص و جلوگیری از آسیب ناتوان کننده مفصل این بیماری مورد نیاز است.درمان بیماران مبتلا به آرتریت روماتوئید هم نیاز به درمان دارویی و هم غیردارویی دارد. امروزه استاندارد مراقبت، درمان زودهنگام با داروهای ضد روماتیسمی اصلاح کننده بیماری است. با وجود درمان، بسیاری از بیماران به ناتوانی می رسند و در طول زمان از عوارض قابل توجهی رنج می برند. برای بهبود نتایج بالینی، یک حمایت دارویی و غیر دارویی جامع (فیزیوتراپی، مشاوره و آموزش بیمار) مورد نیاز است.
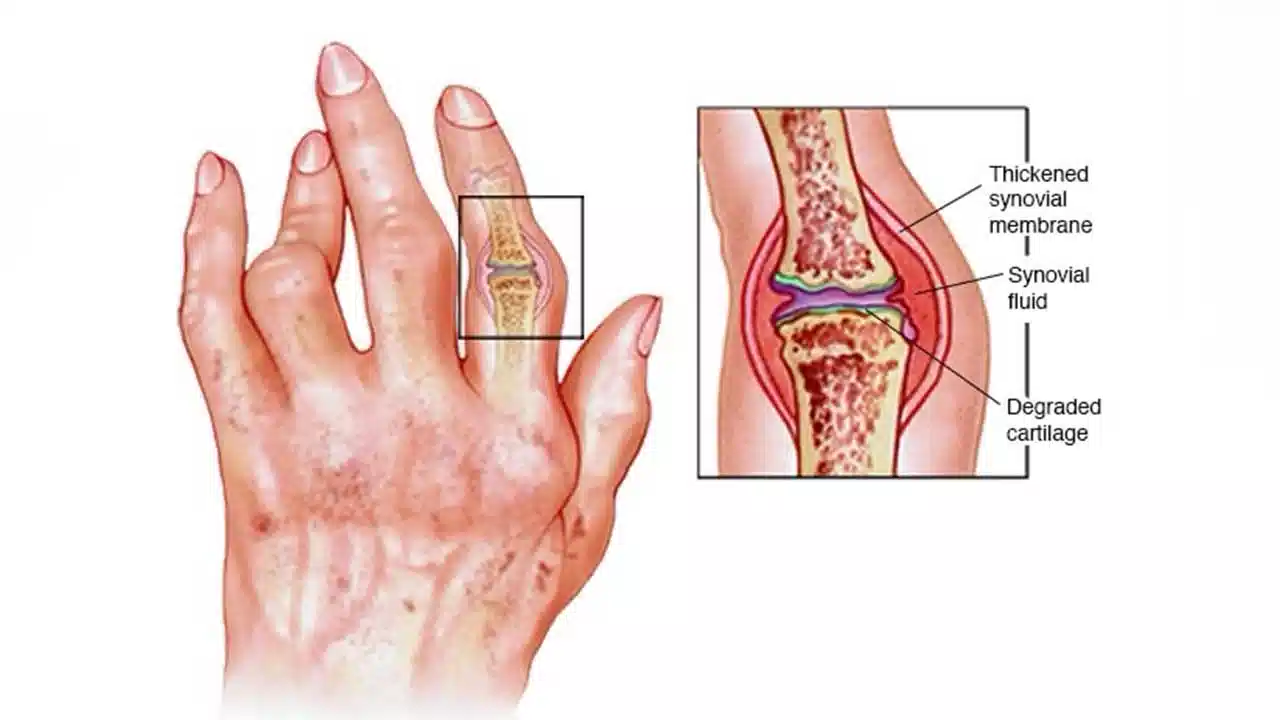
اتیولوژی
اتیولوژی RA ناشناخته باقی مانده است.تصور می شود که از تعامل بین ژنوتیپ و محیط بیمار ناشی می شود. در یک مطالعه سراسری بر روی 91 جفت تک تخمکی (MZ) و 112 دو تخمکی (DZ) در بریتانیا، نرخ همخوانی کلی در تک تخمکی ها 15٪ و 5٪ در بین دوقلوهای دو تخمکی بود. وراثتپذیری آرتریت روماتوئید تقریباً 40 تا 65 درصد برای آرتریت روماتوئید سرم مثبت و 20 درصد برای آرتریت روماتوئید سرم منفی است.خطر ابتلا به آرتریت روماتوئید با آلل های HLA-DRB1 مرتبط است:
HLA-DRB1*04، HLA-DRB1*01، و HLA-DRB1*10.
این آللهای HLA-DRB1 حاوی امتدادی از پنج توالی اسید آمینه حفاظتشده و اپی توپ مشترک (SE) در سومین ناحیه بیشمتغیر زنجیره DRB1 خود هستند که با خطر ابتلا به RA مرتبط است.
پیشنهاد شده است که پلیمورفیسم در مبدلهای سیگنال و فعالکنندههای رونویسی (STAT) -4 و اینترلوکین (IL) -10 ژنها نیز حساسیت به RA را ایجاد میکنند. پلیمورفیسم تک نوکلئوتیدی (SNP) در ژنهای PSORS1C1، PTPN2 و MIR146A با بیماری شدید مرتبط است.
اصطلاح اپی ژنتیک به تغییرات ارثی بدون تغییر توالی DNA اشاره دارد. این تغییرات ممکن است در کروماتین یا DNA وجود داشته باشد. اینها عبارتند از متیلاسیون DNA، تعقیرات هیستون، و تنظیم غیر کد کننده با واسطه RNA. RA-FLS (سینوویوسیتهای شبه فیبروبلاست) تیروزین فسفاتاز SHP-2 را بیش از حد بیان میکنند که توسط ژن PTPN11 کدگذاری شده است در مقایسه با سینوویوسیتهای بیماران استئوآرتریت (OA)، که ماهیت تهاجمی RA-FLS را ترویج میکند. ناحیه تقویتکننده اینترون PTPN11 حاوی دو محل هیپرمتیله است که منجر به تنظیم اپی ژنتیکی غیرطبیعی ژن و تغییر عملکرد RA-FLS میشود. سیگار کشیدن قوی ترین عامل خطر محیطی مرتبط با آرتریت روماتوئید است. مطالعات در افراد مثبت ACPA (آنتی بادی پروتئین ضد سیترولینه) نشان داده است که یک تعامل بین ژن ها و سیگار کشیدن وجود دارد که خطر ابتلا به RA را افزایش می دهد.
اپیدمیولوژی
شیوع RA در سراسر جهان حدود 0.24٪ است.بروز سالانه RA در ایالات متحده و سایر کشورهای غربی شمال اروپا حدود 40 در هر 100000 نفر است.. بر اساس دادههای اپیدمیولوژیک، RA در زنان شایعتر از مردان است، با خطر ابتلا به RA در طول زندگی در زنان 3.6 درصد در مقایسه با 1.7 درصد در مردان. خطر آرتریت روماتوئید نیز با افزایش سن افزایش مییابد و بیشترین میزان بروز آن بین 65 تا 80 سالگی است.همانطور که در بالا ذکر شد، تمایل ژنتیکی نسبت به RA وجود دارد که در یک مطالعه بزرگ در سوئد در سال 2013 حدود 40 درصد نشان داده شد.این مطالعه همچنین وراثت پذیری بالاتری را برای RA مثبت و RA زودرس گزارش کرد. بر اساس گزارش آنها، خطر ابتلا به RA با درجه اول مثبت نسبی برای RA سه برابر بیشتر از بستگان درجه دوم با RA است که این خطر دو برابر بیشتر را نشان میدهد. اکنون چندین استعداد ژنتیکی مختلف برای توضیح این یافته شناسایی شده است. قوی ترین استعداد ژنتیکی برای RA مربوط به ناحیه HLA-DRB1 است.
در میان عوامل خطر قابل اصلاح، سیگار کشیدن قوی ترین ارتباط را با RA دارد. نشان داده شده است که رژیم غذایی و تغذیه نقش مهمی به عنوان محرک های محیطی برای RA دارند. رژیم غذایی معمولی «غربی» که غنی از کالری و کم فیبر است، خطر ابتلا به RA را افزایش می دهد. مصرف اسیدهای چرب اشباع نشده امگا 3 با زنجیره بلند با کاهش خطر ابتلا به RA همراه است.
چاقی یکی دیگر از عوامل خطر ثابت شده برای RA است. خطر ابتلا به آرتریت روماتوئید در بیماران با شاخص توده بدنی (BMI) بیشتر از 30 کیلوگرم بر مترمربع 30 درصد و برای افرادی که BMI بین 25 تا 9/29 کیلوگرم بر متر مربع دارند، 15 درصد افزایش مییابد. ادبیات قابل توجهی در مورد ارتباط RA در بیماران مبتلا به بیماری مزمن مخاطی یا پریودنتال وجود دارد. با این حال، هیچ پیوند واضح و ثابتی در مطالعات دسته بالای تثبیت شده شناسایی نشده است. شواهدی وجود دارد که آسیب مخاطی ناشی از تماس های شغلی و آلاینده های محیطی می تواند خطر ابتلا به RA را افزایش دهد.
پاتوفیزیولوژی
بیماران مبتلا به آرتریت روماتوئید حاوی آنتی بادی هایی برای پروتئین های سیترولینه هستند. سیترولین یک آمینو اسید است که با اصلاح پس از ترجمه باقی مانده های آرژینیل توسط پپتیدیل آرژنین دآمینازها ایجاد می شود. این آنتی بادی ها آنتی بادی های پروتئین ضد سیترولینه (ACPA) نامیده می شوند. ACPA می تواند ایزوتیپ های IgG، IgM یا IgA باشد. ACPA میتواند باقی ماندههای سیترولینهشده را روی پروتئینهای خود مانند ویمنتین، فیبرونکتین، فیبرینوژن، هیستونها و کلاژن نوع 2 متصل کند. اتصال آنتی بادی ها به پروتئین ها منجر به فعال شدن مکمل می شود. وجود آنتی بادی در آرتریت روماتوئید به عنوان RA سرمی مثبت نامیده می شود. ACPA می تواند تا 10 سال قبل از شروع علائم بالینی در سرم وجود داشته باشد. با گذشت زمان غلظت ACPA و سطح سیتوکین سرم افزایش می یابد.
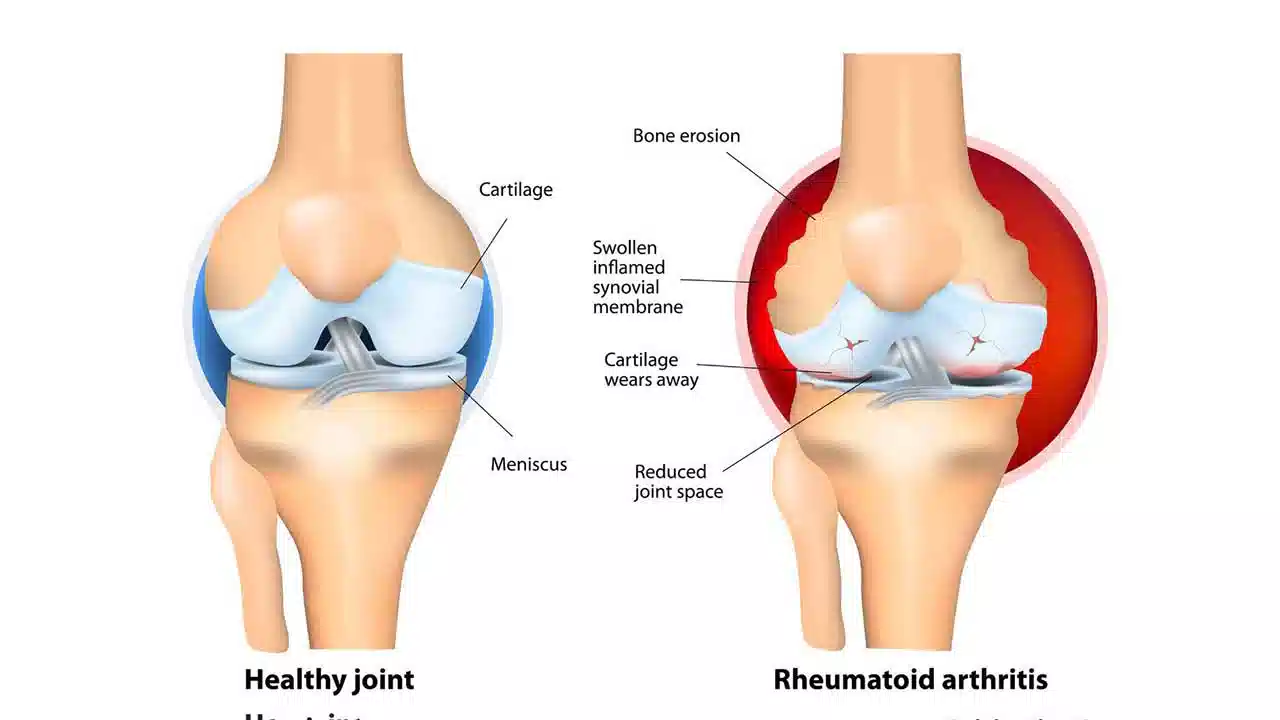
سینوویوم در آرتریت روماتوئید توسط سلول های ایمنی ملتهب میشود که شامل سلول های ایمنی ذاتی (مونوسیت ها، سلول های دندریتیک، ماست سل ها) و سلول های ایمنی سازگار(adaptive) (Th1 (T-helper 1)، Th17 (T-helper 17)، سلول های B، و سلول های پلاسما) است.سیتوکین ها و کموکاین ها مانند فاکتور نکروز تومور (TNF)، اینترلوکین-6 (IL-6)، و عوامل محرک کلنی گرانولوسیت-مونوسیت، سلول های اندوتلیال را فعال می کنند و سلول های ایمنی را در قسمت سینوویال جذب می کنند. فیبروبلاست ها در سینوویوم به یک فنوتیپ تهاجمی تغییر می کنند.سلولهای فیبروبلاست و التهابی منجر به تولید استئوکلاست و در نتیجه فرسایش استخوان میشوند که ویژگی بارز آرتریت روماتوئید است.
تصور می شود که مکانیسم پشت RA ایجاد شده توسط محیط به دلیل فعال شدن مکرر ایمنی ذاتی باشد.
کشیدن سیگار باعث بیان پپتیدیل آرژنین دیمیناز (PAD) در ماکروفاژهای آلوئولی می شود که منجر به تبدیل آرژنین به سیترولین در راه هوایی می شود. این فرآیند یک "نئوآنتی ژن" ایجاد می کند که پاسخ ایمنی را فعال می کند و منجر به تشکیل آنتی بادی های پروتئین ضد سیترولینه (ACPAs) می شود. آنتی بادی های پروتئین ضد کربامیله (anti-CarP) آنتی بادی های پروتئینی اصلاح شده پس از ترجمه (AMPA) مرتبط با RA هستند. کاربامیلاسیون یک واکنش شیمیایی با واسطه سیانید است که در آن لیزین به هموسیترولین تبدیل می شود. ساختار مولکولی هوموسیترولین مشابه سیترولین است. با این حال، آنتیبادیهای ضد CarP، آنتیبادیهای متمایزی هستند که هم در بیماران ACPA مثبت و هم در بیماران ACPA منفی با RA مرتبط هستند.
آنتیبادیهای پروتئین ضد استیله اخیراً با RA (تقریباً در 40٪ از بیماران RA)، عمدتاً در بیماران سرم مثبت همراه شده است. استیلاسیون یک فرآیند آنزیمی است که تصور می شود توسط باکتری ها واسطه می شود، که ممکن است ارتباطی با RA و دیس بیوز میکروبیوم ایجاد کند. مکانیسم دقیق در این زمان نامشخص است.
توجه به این نکته مهم است که بیوپسی سینوویال در بیماران سرم مثبت مبتلا به آرترالژی اساساً دچار تعقیرات قابل توجه نبود. این نظریه وجود دارد که یک محرک محیطی دوم برای ایجاد بیماری آشکار بالینی مورد نیاز است. هنگامی که این امر ایجاد شد، یک فرآیند التهابی مخرب شروع می شود. سینوویوسیتهای فیبروبلاست مانند (FLS) از مفصلی به مفصل دیگر مهاجرت میکنند که منجر به آسیب تدریجی مفصل میشود.
هیستوپاتولوژی
یکی از اولین یافته های هیستوپاتولوژیک در RA رشد عروق خونی سینوویال جدید است. این پدیده منجر به انتقال لنفوسیت ها و لکوسیت های پلی مورفونوکلئر به مایع سینوویال می شود. رگ زایی برای حمایت از سینوویوم کاتابولیک مورد نیاز است و از طریق سایتوکاین های پیش التهابی مانند فاکتور نکروز تومور (TNF) انجام می شود. با رگ زایی، سیتوکین ها سلول های اندوتلیال را برای تولید مولکول های چسبنده( adhesion molecules )فعال می کنند که به نوبه خود مهاجرت سلولی به سینوویوم را تسهیل می کند. با وجود رگزایی زیاد، مایع سینوویال RA یک محیط هیپوکسیک است که منجر به افزایش تولید ایکوزانوئیدهای درد مشتق از سیکلواکسیژناز (COX) 2 و متالوپروتئینازهای ماتریکس (MMPs) می شود. این باعث تحریک بیشتر یک پاسخ التهابی در سینوویوم می شود. در مرحله اولیه بیماری، هجوم سلول های التهابی به غشای سینوویال منجر به تکثیر مونوسیت ها و ضخیم شدن غشای سینوویال با برآمدگی های پرزمانند کوچک به فضای مفصل می شود.
گره های روماتوئید در ابتدا دارای یک پدیده واسکولیت عروق کوچک هستند و به دنبال آن یک فاز گرانولوماتوز التهابی مزمن ایجاد می شود. ایجاد گره های روماتوئید در آرتریت روماتوئید مکرر است و درم یا ساب درمرا در نواحی اطراف مفصلی درگیر می کند. هنگامی که متعدد باشد، این پدیده می تواند به درمان با متوترکسات مرتبط باشد و به آن ندولوز روماتوئید تسریع شده (accelerated rheumatoid nodulosis ) می گویند. اندازه آن متغیر است و می تواند از چند میلی متر تا سانتی متر متغیر باشد. این ضایعه به صورت یک ضایعه فیبری متمایل به سفید با نواحی زرد رنگ مربوط به نکروز کلاژنی است ظاهر می شود. ظاهر بافتی می تواند از گرانولوم حلقوی قابل تشخیص نباشد. مناطقی از نکروبیوز نامنظم جغرافیایی مانند درم و هیپودرم وجود دارد که توسط هیستوسیتهایی که در یک دیواره به خوبی توسعهیافته، لنفوسیتها و نوتروفیلها مرتب شدهاند احاطه شدهاند. گاهی اوقات، سلول های غول پیکر و ماست سل ها می توانند وجود داشته باشند. فیبرین و کلاژن در مرکز نواحی نکروبیوتیک وجود دارد. درم و هیپودرم اطراف دارای انفیلتراسیون دور عروقی از سلول های پلاسما هستند.
شرح حال و معاینه فیزیکی RA
شرح حال
شایع ترین و غالب ترین علائم شامل درد و سفتی مفاصل، به ویژه سفتی و تورم صبحگاهی است. معمولاً شروع علائم آهسته است. با این حال، در برخی موارد، یک الگوی اپیزودیک از علائم را می توان مشاهده کرد و به عنوان روماتیسم پالیندرومیک تعریف می شود. همه بیماران مبتلا به روماتیسم پالیندرومیک به RA مبتلا نمی شوند و به طور علامتی به هیدروکسی کلروکین پاسخ می دهند که این ایده را تایید می کند که روماتیسم پالیندرومیک پیش ساز RA است. همانطور که در بالا توضیح داده شد، RA شامل مفاصل کوچک محیطی، معمولاً دست ها می شود. درگیری مفصل محوری، به ویژه در ناحیه کمر، شایع نیست. با این حال، درگیری مفصل های گردن در RA طولانی مدت می تواند وجود داشته باشد. اگرچه درگیری چند مفصل کوچک یک ویژگی مکرر است، برخی از بیماران ممکن است با درگیری تک مفصلی و خارج مفصلی مراجعه کنند.
معاینه فیزیکی
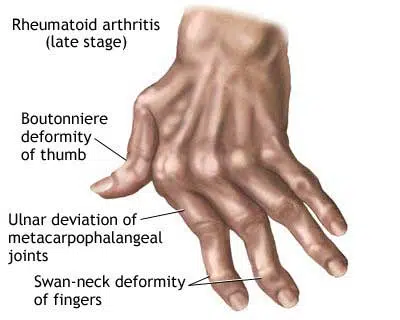
در معاینه فیزیکی، در صورت اعمال فشار به مفصل یا حرکت با یا بدون تورم مفصل، مفصل آسیب دیده دردناک خواهد بود. ضخیم شدن سینوویال در لمس مشاهده خواهد شد. اریتم و گرمی مفصل معمولاً وجود ندارد و درگیری مچ دست ممکن است با علائم و نشانههای معمولی سندرم تونل کارپال ظاهر شود. با درگیری مفاصل متعدد، کاهش قدرت مفصل در تست فیزیکی مشاهده خواهد شد. یافته های فیزیکی کلاسیک انحراف اولنار، سابلوکساسیون مفصل متاکارپوفالانژیال، انحراف اولنار، بدشکلی گردن قو، تغییر شکل Boutonniere در بیماری مزمن پیشرفته دیده می شود.
ندول های روماتوئید شایع ترین تظاهرات پوستی RA هستند. آنها معمولاً در نقاط تحت فشار مانند اولکرانون یافت می شوند. بیماران RA می توانند ضایعات پوستی اولسراتیو نیز داشته باشند و تصور می شود که به دلیل استاز وریدی، نارسایی شریانی، ارتشاح نوتروفیلی و/یا واسکولیت باشد.
واسکولیتی که رگ های خونی با اندازه متوسط و کوچک را درگیر می کند نیز می تواند به عنوان یکی از علائم RA دیده شود. با این حال، شیوع واسکولیت در بیماران مبتلا به RA کم است. بیماران مبتلا به واسکولیت روماتوئید ممکن است مونونوریت مالتی پلکس یا پلی نوروپاتی نامتقارن را نشان دهند. شکل ثانویه بیماری شوگرن با آرتریت روماتوئید مرتبط است. این شامل علائم خشکی چشم و/یا دهان به عنوان علائم بارز است.
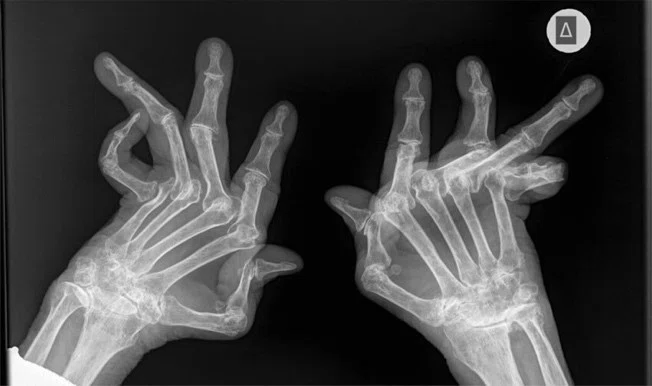
ارزيابي آزمايشگاهي
آزمایشات آزمایشگاهی معمولاً کم خونی بیماری مزمن و ترومبوسیتوز را نشان می دهد. در صورت وجود سندرم فلتی ممکن است نوتروپنی وجود داشته باشد. حدود 75 تا 85 درصد از بیماران مبتلا به RA برای فاکتور روماتوئید (RF)، ACPA یا هر دو مثبت خواهند شد. این بیماران به عنوان RA سرولوژی مثبت تعیین می شوند. حدود 45 تا 75 درصد از بیماران مبتلا به آرتریت روماتوئید از نظر فاکتور روماتوئید مثبت هستند. با این حال، وجود فاکتور روماتوئید تشخیصی برای آرتریت روماتوئید نیست. ممکن است در سایر بیماری های بافت همبند، عفونت های مزمن و افراد سالم وجود داشته باشد، البته در عیار پایین.
آنتی بادی های پروتئین ضد سیترولینه (ACPA) در حدود 50 درصد از بیماران مبتلا به آرتریت اولیه یافت می شود که متعاقباً با آرتریت روماتوئید تشخیص داده می شود. اگر هر دو RF و ACPA مثبت باشند، حساسیت و ویژگی تشخیص به طور قابل توجهی افزایش می یابد. واکنشدهندههای فاز حاد، مانند سرعت رسوب گلبول قرمز (ESR) و سطح پروتئین واکنشگر C (CRP)، معمولاً در بیماران مبتلا به بیماری فعال افزایش مییابد و باید در نظر گرفته شوند.
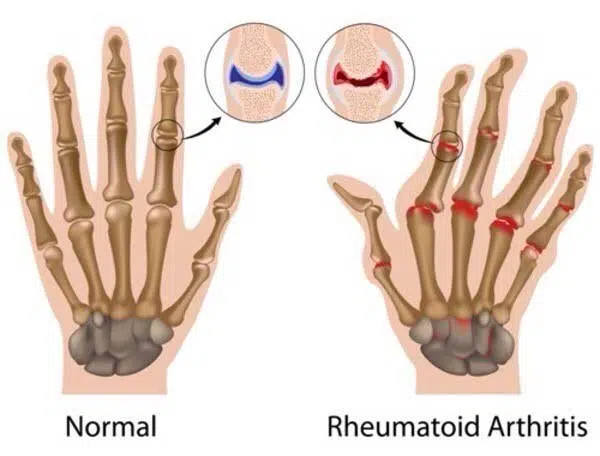
معاینه مایع سینوویال معمولاً تعداد لکوسیتها را بین 1500 تا 25000/mm مکعب نشان میدهد و عمدتاً سلولهای پلیمورفونوکلئر هستند. تعداد سلول های بالاتر از 25000/mm مکعب نادر است و با بیماری بسیار فعال قابل مشاهده است. با این حال، آزمایشات لازم را برای رد عفونت زمینه ای باید انجام داد. مایع سینوویال در RA همچنین سطوح پایین C3 و C4 را با وجود افزایش سطح سرمی نشان می دهد. در بیماری پیشرفته، درگیری مفصل در رادیوگرافی ساده، استئوپنی اطراف مفصلی، باریک شدن فضای مفصلی و فرسایش استخوانی را آشکار می کند. فرسایش غضروف و استخوان از یافته های پاتگنومونیک برای RA در نظر گرفته می شود. با این حال، این یافته ها با بیماری پیشرفته سازگار است. تصویربرداری رزونانس مغناطیسی (MRI) و سونوگرافی در مراحل اولیه بیماری قبل از وقوع شواهد رادیوگرافیک از فرسایش استخوان مفید هستند. سیگنال کاهش یافته از مغز استخوان در تصاویر با T1 و تصاویر تقویت شده با گادولینیم نشان دهنده ادم مغز استخوان است. MRI همچنین می تواند ضخیم شدن سینوویال را نشان دهد، که نشان داده شده است که حضور آتی فرسایش استخوانی را پیش بینی می کند. کاربرد بالینی MRI و ادغام آن در معیارهای تشخیصی برای RA هنوز مشخص نیست.
ارزيابي تشخيصي
با توجه به تظاهرات بالینی متفاوت و فقدان آزمایش پاتگنومونیک جهانی برای RA، تشخیص بیماری می تواند چالش برانگیز باشد. به طور سنتی وجود حداقل چهار مورد از معیارهای زیر برای حداقل شش هفته، بیمار را به عنوان مبتلا به RA طبقه بندی می کند. این معیارها عبارت بودند از: سفتی صبحگاهی، آرتریت سه یا چند مفصل، آرتریت دست، آرتریت متقارن، افزایش واکنش دهنده های فاز حاد، افزایش فاکتور روماتوئید، و شواهد رادیولوژیک RA.
این معیارها آرتریت التهابی را از غیر التهابی جدا میکردند، اما برای RA خیلی اختصاصی نبودند. همچنین برای RA در مراحل اولیه حساس نبود، که یک اشکال قابل توجه بود. با توسعه آزمایشات سرولوژیک، معیارهای تشخیصی دوباره تعریف شدند. معیارهای تشخیصی دانشکده روماتولوژی آمریکا در سال 2010 و اتحادیه اروپا علیه روماتیسم (ACR/EULAR) برای RA در زیر مشخص شده است. این معیارها شامل چهار دامنه مختلف است که به شرح زیر است:
معیارهای تشخیصی ACR/EULAR 2010 برای RA
- تعداد و محل مفاصل درگیر 2 تا 10 مفصل بزرگ = 1 نقطه (شانه، آرنج، باسن، زانو و مچ پا)
- 1 تا 3 مفصل کوچک = 2 نقطه (مفاصل متاکارپوفالانژیال، مفاصل بین فالانژیال پروگزیمال، مفاصل متاتارسوفالانژیال دوم تا پنجم، مفاصل بین فالانژیال شست و مچ دست)
- 4 تا 10 مفصل کوچک = 3 امتیاز
- بیشتر از 10 مفصل (شامل حداقل 1 مفصل کوچک) = 5 امتیاز -آزمایش سرولوژیک برای فاکتور روماتوئید یا آنتی بادی پپتید/پروتئین ضد سیترولینه مثبت کم = 2 امتیاز ،مثبت بالا = 3 امتیاز -واکنش دهنده فاز حاد بالا (نرخ رسوب گلبول قرمز [ESR] یا پروتئین واکنشی C [CRP]) = 1 امتیاز
- طول مدت علائم حداقل شش هفته = 1 امتیاز
نمره کل بیشتر یا مساوی 6 بیمار را به عنوان مبتلا به RA طبقه بندی می کند. ذکر این نکته ضروری است که درگیری مفصل به هر مفصل متورم یا حساس در معاینه اشاره دارد. همچنین ممکن است از مطالعات تصویربرداری برای تعیین وجود سینوویت/درگیری مفصل استفاده شود. معیارهای ACR/EALAR 2010 مفاصل بین فالانژیال دیستال، مفاصل اول کارپومتاکارپ و اولین مفاصل متاتارسوفالانژیال را از این معیار حذف کردند. همچنین، این معیار ممکن است فقط برای بیمارانی اعمال شود که درگیری مفصل با سایر بیماریهای التهابی، مانند لوپوس اریتماتوز سیستمیک یا پسوریازیس، بهتر توضیح داده نمیشود. برای رد این بیماری ها باید آزمایش های خاصی انجام شود. معیارهای جدید برای پیشبینی بهتر احتمال RA، حساسیت مشابه معیارهای قبلی برای تشخیص RA و دارای ویژگی بالاتر و همچنین ارزش اخباری منفی بالاتری هستند.
درمان و مدیریت بیماری ارتریت روماتوئید
هدف از درمان در بیماران مبتلا به RA، تشخیص زودهنگام و شروع زودهنگام درمان برای جلوگیری از آسیب غیرقابل برگشت به مفاصل است. دستورالعملهای گروه کاری بینالمللی که در سال 2014 منتشر شد، توصیههای زیر را در مورد درمان RA ارائه میکند:
- هدف اولیه درمان دستیابی به بهبودی بالینی طولانی مدت و بهینه سازی کیفیت زندگی با عدم وجود علائم و نشانه های مرتبط با فعالیت بیماری التهابی است.
- اگر بهبودی بالینی قابل دستیابی نباشد، فعالیت کم بیماری یک جایگزین قابل قبول است.
- فعالیت بیماری باید هر ماه در بیماران با فعالیت بیماری متوسط تا شدید ارزیابی شود. در بیماران با فعالیت کم بیماری یا بهبودی بالینی، فعالیت بیماری باید هر 3 تا 6 ماه یکبار ارزیابی شود.
ابزارهای ارزیابی بالینی متعددی برای کمک به پزشکان در تعیین فعالیت بیماری بیماران مبتلا به RA ایجاد شده است. یک توصیه به روز شده از دانشکده آمریکایی روماتولوژی (ACR) در سال 2019 استفاده از ابزارهای ارزیابی زیر را توصیه می کند:
- شاخص فعالیت بیماری های بالینی (CDAI)
- امتیاز فعالیت بیماری (DAS)
- امتیاز فعالیت بیماری 28 مفاصل (DAS28-ESR/CRP) DAS28 مشتق از بیمار شاخص بیمارستان دانشگاه لا پرینسزا (HUPI)
- امتیاز فعالیت بیماری چند نشانگر زیستی (امتیاز MBDA، VECTRA DA)
- شاخص فعالیت بیماری آرتریت روماتوئید (RADAI)
- شاخص فعالیت بیماری آرتریت روماتوئید 5 (RADAI-5)
- ارزیابی معمول دادههای شاخص بیمار 3 (RAPID3)
- ارزیابی روتین دادههای شاخص بیمار 5 (RAPID5)
- شاخص فعالیت بیماری ساده شده (SDAI)
داروهای ضد روماتیسمی اصلاح کننده بیماری (DMARDs) که معمولاً در درمان RA استفاده می شود شامل متوترکسات، هیدروکسی کلروکین، سولفاسالازین و لفلونوماید است.
عوامل ضد TNF-alpha شامل اتانرسپت، اینفلیکسیماب، آدالیموماب، گلیموماب و سرتولیزوماب پگول هستند. DMARDهای بیولوژیک غیر TNF شامل آنتاگونیست های گیرنده اینترلوکین (IL) 6 مانند توسیلیزوماب و ساریلوماب، مسدود کننده های سلول T مانند آباتاسپت (CTLA4-Ig) و آنتی بادی مونوکلونال ضد CD20 سلول B مانند ریتوکسیماب هستند. سایر داروهای DMARD مصنوعی شامل مهارکننده های Janus kinases (JAK) مانند tofacitinib، baricitinib و upadacitinib هستند.
درمان با DMARD، از جمله عوامل بیولوژیک و عوامل درمانی هدفمند (توفاسیتینیب)، باید به طور موقت در بیماران مبتلا به عفونت فعال جدی متوقف شود. آنها را می توان پس از رفع عفونت و تکمیل درمان ضد میکروبی از سر گرفت. لازم به یادآوری است که تمام بیمارانی که درمان را برای RA شروع می کنند باید از نظر هپاتیت B و C و سل غربالگری شوند. در بیماران مبتلا به آسیب کبدی باید از مصرف متوترکسات اجتناب شود. بیماران مبتلا به سل نهفته باید حداقل یک ماه قبل از شروع داروهای بیولوژیک درمان را کامل کنند. اگر بیماران نتوانند درمان سل نهفته را انجام دهند یا کامل کنند، باید از درمان مرسوم DMARD استفاده شود. در بیماران مبتلا به سرطان پوست و اختلالات لنفوپرولیفراتیو زمینه ای، باید از عوامل بیولوژیک به جز ریتوکسیماب در بیماران مبتلا به اختلالات لنفوپرولیفراتیو اجتناب شود، زیرا شواهدی مبنی بر منفعت از سرکوب سلول های B در این موارد وجود دارد. ACR همچنین توصیه می کند که قبل از شروع درمان برای RA، بیماران باید واکسیناسیون پنوموکوک، هپاتیت، آنفولانزا، ویروس پاپیلومای انسانی (HPV) و ویروس هرپس زوستر (HZV) را دریافت کنند.
DMARDهای غیر بیولوژیک
این دسته شامل هیدروکسی کلروکین (HCQ)، آزاتیوپرین (AZA)، سولفاسالازین، متوترکسات، لفلونوماید و سیکلوسپورین است. متوترکسات اولین داروی انتخابی برای بیماران مبتلا به RA است. برنامه درمانی توصیه شده دوز اولیه 15 میلی گرم در هفته متوترکسات با افزایش 5 میلی گرم در ماه و دوز هدف 25 تا 30 میلی گرم در هفته را توصیه می کند. در بیمارانی که پاسخ کافی به مصرف خوراکی ندارند، می توان تزریق زیر جلدی را امتحان کرد.
مهارکننده های TNF
مهارکننده های TNF شامل اتانرسپت، اینفلیکسیماب، آدالیموماب، سرتولیزوماب و گلیموماب هستند. ACR استفاده از مهارکنندههای TNF را تا زمانی که یک DMARD غیربیولوژیکی آزمایش نشده است توصیه نمیکند.[42] با این حال، مطالعات نشان دادهاند که افزودن مهارکنندههای TNF در بیمارانی که در درمان با متوترکسات شکست خوردهاند، بهتر از افزودن DMARD غیربیولوژیکی دیگر است. نگران کننده ترین اثر نامطلوب این عوامل عفونت های فرصت طلب و فعال شدن مجدد سل نهفته است. نگرانی هایی در مورد تولید آنتی بادی ها علیه این عوامل وجود دارد که ممکن است در طول زمان اثربخشی آنها را کاهش دهد. با این حال، استفاده از متوترکسات در ترکیب با این عوامل نشان داده است که این عارضه را کاهش می دهد. عفونت حاد، نارسایی پیشرفته قلبی، و بدخیمی های اخیر منع مصرف برای استفاده از این عوامل هستند.
ریتوکسیماب
ریتوکسیماب یک داروی بیولوژیکی غیر TNF DMARD است که اگر بیماران مبتلا به RA کنترلنشدهاند و با درمان TNF بهبود نیافتهاند، میتوان آن را برای درمان RA اضافه کرد. ریتوکسیماب سلول های B CD20+ را سرکوب می کند و پاسخ ایمنی به واکسن ها را در بیماران دریافت کننده ریتوکسیماب کاهش می دهد. همانطور که در بالا گفته شد، این یک عامل ارجح در بیماران مبتلا به اختلالات لنفوپرولیفراتیو زمینه ای است.
آباتاسپت Abatacept
با اتصال به CD80 و CD86 از فعال شدن سلول های T جلوگیری می کند. این دارو به صورت انفوزیون داخل وریدی ماهانه یا به صورت تزریق زیر جلدی هفتگی تجویز می شود. بیماران مبتلا به RA کنترلنشده، که پاسخ ناکافی به درمان با متوترکسات و مهارکنندههای TNF نشان دادهاند، از درمان با آباتاسپت با اثربخشی ثابت از 6 ماه تا 5 سال درمان بهرهمند میشوند.
مهارکننده های اینترلوکین 6
توسیلیزوماب، یک مهارکننده گیرنده IL-6، برای RA فعال متوسط تا شدید در بزرگسالانی که پاسخ ناکافی به درمان با مهارکننده های TNF داشته اند، اندیکاسیون دارد. این بیماران با استفاده از توسیلیزوماب از نظر بالینی بهبود معنی داری پیدا می کنند. ساریلوماب
عامل دیگری در این دسته است که نشان داده شده است علیرغم درمان با مهارکننده های TNF، نتایج بالینی را در بیماران مبتلا به RA کنترل نشده بهبود می بخشد.
مهارکننده های ژانوس کیناز (JAK)
JAK گروهی از تیروزین کیناز است که در انتقال سیگنال درون سلولی برای خون سازی و عملکرد سلول های ایمنی شرکت می کند. مهارکنندههای JAK (مانند توفاسیتینیب) تولید سیتوکینها را کاهش میدهند و بهعنوان عوامل خط دوم برای درمان RA تأیید شدهاند.

دستورالعمل های درمانی ACR و EULAR :
- طبق دستورالعملهای درمان ACR برای RA اولیه، بیمارانی که درمان با داروهای ضدروماتیسمی اصلاحکننده بیماری (DMARD) را مصرف نکردهاند، بدون توجه به سطح فعالیت، باید درمان DMARD را شروع کنند.
- در بیماران با فعالیت کم بیماری و بیماری زودرس، مونوتراپی با متوترکسات درمان ارجح است. لفلونوماید یا سولفاسالازین خط اول درمان در بیمارانی است که منع مصرف متوترکسات یا عدم تحمل آن را دارند.
- اگر تک درمانی با DMARD فعالیت بیماری را کنترل نکند (صرف نظر از مصرف همزمان گلوکوکورتیکوئید)، درمان باید تغییر یابد. متوترکسات را می توان در این مرحله ادامه داد یا قطع کرد.
- گزینه های درمانی اضافی پس از تک درمانی ناموفق با DMARD به عنوان درمان دوگانه سنتی/غیر بیولوژیکی DMARD، مهارکننده های فاکتور نکروز تومور (TNF) یا عوامل بیولوژیکی فاکتور نکروز غیر توموری توصیه می شود.
- در بیماران مبتلا به آرتریت روماتوئید تثبیت شده، که DMARD ساده هستند، متوترکسات بدون توجه به سطح فعالیت بیماری، داروی ارجح برای تک درمانی اولیه است. اگر مونوتراپی با DMARD فعالیت بیماری را در RA ایجاد شده کنترل نکند (بدون توجه به مصرف همزمان گلوکوکورتیکوئید)، درمان دوگانه DMARD، یک مهارکننده TNF، یک عامل بیولوژیک غیر TNF، یا درمان با توفاسیتینیب میتواند اضافه شود.
- اگر فعالیت بیماری در تک درمانی با مهارکننده TNF بالا بماند، درمان DMARD باید علاوه بر مهارکننده TNF اضافه شود.
- اگر فعالیت بیماری با وجود مهارکننده ضد TNF بالا باقی بماند، به یک عامل بیولوژیک غیر TNF با یا بدون متوترکسات بروید.
- اگر فعالیت بیماری علیرغم آزمایش عوامل ضد TNF و غیر TNF همچنان بالاست، قبل از مصرف توفاسیتینیب از یک عامل بیولوژیک غیر TNF دیگر استفاده کنید.
- اگر با وجود کارآزمایی های فوق هنوز کنترل نشده اید، از توفاسیتینیب استفاده کنید.
- اگر فعالیت بیماری با وجود درمانهای ترکیبی بالا همچنان بالا بماند، درمان کوتاهمدت گلوکوکورتیکوئید با دوز پایین باید اضافه شود.
- در بیماران مبتلا به نارسایی احتقانی قلب باید از مهارکننده های TNF اجتناب شود.
- بیماران مبتلا به هپاتیت C که تحت درمان قرار نگرفته اند یا در حال حاضر تحت درمان نیستند، باید به جای مهارکننده های TNF، درمان غیربیولوژیکی DMARD دریافت کنند
تشخیص های افتراقی
- لوپوس اریتماتوی سیستمیک
- بیماری مزمن لایم
- آرتروز آرتریت
- سپتیک آرتریت
- پسوریاتیک
- سندرم شوگرن
- سارکوئیدوز
Stages of RA
همانطور که توسط ACR تعریف شده است:
مرحله 1: بدون تغییر مخرب در اشعه ایکس
مرحله 2: وجود شواهد اشعه ایکس از پوکی استخوان اطراف مفصلی، تخریب استخوان زیر غضروفی اما بدون تغییر شکل مفصل مرحله 3: شواهد اشعه ایکس از تخریب غضروف و استخوان علاوه بر بدشکلی مفصل و پوکی استخوان اطراف مفصلی
مرحله 4: وجود آنکیلوز استخوانی یا فیبری همراه با ویژگی های مرحله سوم
پروگنوز بیماری
آرتریت روماتوئید درمان ندارد و یک بیماری پیشرونده است. همه افراد تشدیدهای متعددی را تجربه خواهند کرد و بدون درمان، پیامدهای ضعیفی با افزایش ناتوانی و مرگ و میر خواهند داشت. درمان زودهنگام (در عرض شش ماه پس از شروع علائم) بهبود ظرفیت عملکردی و کاهش فعالیت بیماری را نشان داده است که با تعداد مفاصل متورم و تعداد مفصل حساس اندازهگیری میشود. با این حال، میزان مرگ و میر در بیماران دریافت کننده درمان اولیه و دیرهنگام (پس از شش ماه علائم) مشابه بود و هر دو به طور قابل توجهی از درمان سود می بردند. تقریباً 40 درصد از بیماران مبتلا به RA دارای ناتوانی عملکردی هستند که بر توانایی آنها در کار و انجام فعالیت های روزمره زندگی در طی ده سال پس از تشخیص تأثیر می گذارد. بیماران مبتلا به آرتریت روماتوئید نیز دچار سایر عوارض مزمن می شوند که به شدت بر نتایج آنها تأثیر می گذارد. قابل توجه ترین این عوارض، رابطه بین RA و بیماری قلبی عروقی آترواسکلروتیک است که منجر به تسریع بیماری عروق کرونر می شود. RA خطر ابتلا به بیماری های قلبی عروقی، بیماری های ریوی و بدخیمی ها را افزایش می دهد که به نوبه خود خطر مرگ و میر زودرس را در این بیماران افزایش می دهد.
نتیجه گیري
آرتریت روماتوئید (RA) یک بیماری خودایمنی سیستمیک است که با آرتریت التهابی و درگیری خارج مفصلی مشخص می شود. این بیماری یک اختلال التهابی مزمن با علت ناشناخته است که عمدتاً مفاصل سینوویال را درگیر می کند.
RA دارای یک جزء ژنتیکی قوی است و نمی توان به طور کامل از آن اجتناب کرد. با این حال، عوامل خطر قابل تغییر مانند سیگار کشیدن و مصرف یک رژیم غذایی متعادل باید مورد توجه قرار گیرند. به بیمارانی که در معرض خطر ابتلا به آرتریت روماتوئید هستند توصیه می شود که رژیم غذایی متعادلی داشته باشند، به طور منظم ورزش کنند و وزن بدن خود را سالم نگه دارند.
این مقاله توسط دانشجویان پزشکی،سید مصطفی زمانی و عرفان باروتچی گردآوری و صحت علمی آن مورد بررسی قرار گرفت.
-1664193992.webp&w=3840&q=75)