کم خونی ناشی از فقر آهن و مدیریت درمانی آن
کم خونی فقر آهن زمانی ایجاد می شود که تعادل دریافت آهن، ذخایر آهن و از دست دادن آهن بدن برای حمایت کامل از تولید گلبول های قرمز کافی نباشد. کم خونی فقر آهن به ندرت باعث مرگ می شود، اما تاثیر آن بر سلامت انسان قابل توجه است. در کشورهای توسعه یافته، این بیماری به راحتی قابل شناسایی و درمان است، و اغلب توسط پزشکان به راحتی درمان میشود. در مقابل، فقر آهن یک مشکل بهداشتی است که بخش عمده ای از جمعیت کشورهای توسعه نیافته را تحت تاثیر قرار می دهد. به طور کلی، پیشگیری و درمان موفقیتآمیز کمخونی فقر آهن در سرتاسر جهان، بهویژه در میان زنان و کودکان محروم، بسیار ناکافی است. در اینجا، ویژگیهای بالینی و آزمایشگاهی این بیماری مورد بحث قرار میگیرد و سپس بر عوامل اقتصادی، محیطی، عفونی و ژنتیکی مرتبط که در بین جمعیتهای جهانی وجود دارند، تمرکز میشود. آهن ۵ درصد از پوسته زمین را تشکیل می دهد. حالت های ردوکس آن باعث می شود آهن برای تکامل فرآیندهای بیولوژیکی نیاز باشد.
چهار دسته کلی از پروتئین ها حاوی آهن هستند:
- پروتئین های آهن تک هسته ای (مانند سوپراکسید دیسموتاز)
- پروتئین های دی فرو-کربوکسیلات (مانند ریبونوکلئوتید ردوکتاز، فریتین)
- پروتئین های آهن-گوگرد (مانند آکونیتاز)
- پروتئین های هِم (مثلاً هموگلوبین)
در بین این چهار دسته، سه گروه اول پروتئین در سطوح پایینتری وجود دارند، اما از نظر عملکردی مهم هستند.
هموگلوبین فراوان ترین پروتئین حاوی آهن در انسان است. بیش از نیمی از آهن کل بدن در هموگلوبین موجود است.
بر اساس محل هموگلوبین در گلبول های قرمز، کم خونی یک صفت مشخصه کمبود آهن است. علیرغم فراوانی آهن در زمین، کمبود آهن در انسان بسیار شایع است و شایع ترین علت کم خونی در سراسر جهان است. برای درک کامل تر کم خونی فقر آهن، باید به مفاهیم عرضه و تقاضای آهن برای تولید گلبول های قرمز توجه کرد. نیازهای مرتبط با گلبول قرمز برای آهن توسط سه متغیر ایجاد می شود: اکسیژن رسانی به بافت، گردش گلبول های قرمز و از دست دادن گلبول های قرمز در اثر خونریزی نیاز به اکسیژن رسانی بافتی و تولید گلبول های قرمز به طور کلی در دوران بزرگسالی در غیاب خونریزی، بیماری یا فعالیت بدنی تغییر یافته ثابت می ماند. به این ترتیب، هموستاز آهن (شکل 1) نیز پایدار می ماند.
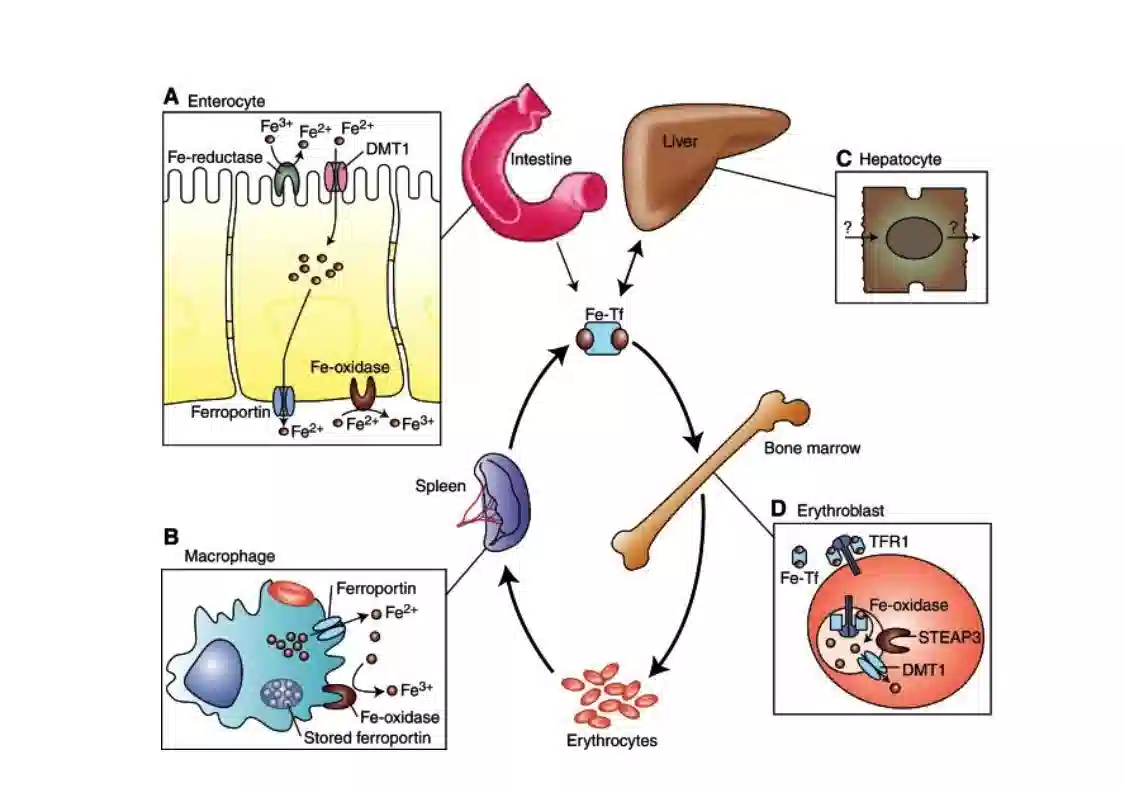
روزانه تقریباً خون از ۲۰ میلی لیتر از گلبول های قرمز پیر پاک می شود و ۲۰ میلی گرم آهن موجود در آن سلول ها برای تولید گلبول های قرمز جدید بازیافت می شود. به دلیل نیمه عمر کوتاه تر گلبول های قرمز در گردش در کم خونی فقر آهن، آهن در آن بیماران زودتر بازیابی می شود، اما میزان آهن در هر گلبول قرمز میکروسیتیک کاهش می یابد. در صورت خونریزی، آهن اضافی باید از رژیم غذایی جذب شود تا نیازهای حالت پایدار میزبان را برآورده کند.
گلبول های قرمز و پیش سازهای آنها به مقادیر زیادی آهن برای تولید هم (شکل 2) و هموگلوبین نیاز دارند.
وجود آهن برای ساختار و عملکرد هموگلوبین نیاز است (Perutz 1982). فوری ترین منبع آهن برای اریتروبلاست ها ترانسفرین مونو یا دیفریک است که در غلظت های بالا در پلاسما یافت می شود. کم خونی فقر آهن معمولاً با اشباع کم آهن ترانسفرین موجود همراه است. آهن از سه منبع روی ترانسفرین دیفریک بارگیری می شود: روده (رژیم غذایی)، ماکروفاژها (آهن بازیافتی) و کبد (آهن فریتین ذخیره شده). به طور کلی، قبل از اینکه میزبان دچار کم خونی شود، ابتدا ذخایر آهن کاهش می یابد یا از بین می رود. بنابراین، آهن رژیمی و بازیافت شده توسط گلبول های قرمز باید نیازهای تولید گلبول های قرمز را برآورده کند. اگر تلفات آهن ادامه یابد، در گلبول های قرمز تازه تولید شده هموگلوبین کاهش یافته و باعث می شود مقدار آهنی که توسط همان تعداد گلبول های قرمز در حال پیری تامین می شود کاهش یابد. برخلاف صفت تالاسمی، افزایش تعداد گلبول های قرمز در حالت کمبود آهن برای جبران کاهش محتوای هموگلوبین داخل سلولی ایجاد نمی شود. به همین دلیل، رتیکولوسیتوز معمولا وجود ندارد. در غیاب خونریزی عمده، کم خونی فقر آهن عموماً در طی چند ماه یا سال به کندی ایجاد می شود. رفع کم خونی فقر آهن بسته به در دسترس بودن آهن در رژیم غذایی و همچنین کفایت عملکرد دستگاه گوارش ممکن است به همان اندازه کند باشد.
برای چندین دهه، تشخیص و درمان کامل کم خونی ناشی از فقر آهن با هزینه نسبتا کم امکان پذیر بوده است. متاسفانه کمبود آهن به عنوان شایع ترین کم خونی و اختلال تغذیه ای در سراسر جهان باقی مانده است. این پارادوکس ظاهراً غیرقابل توضیح شیوع بالا علیرغم درمان مؤثر، چالش بزرگی برای تلاشهای بهداشت عمومی است. موانع متعدد اقتصادی، موانع فرهنگی و بیماریهای عفونی همگی ریشهکنی این بیماری را دشوارتر میکنند.
برای دستیابی به موفقیت درمانی در جامعه جهانی، باید بر چالشهای اضافی که توسط خرده جمعیتهای انسانی خاص در مناطق جغرافیایی منتخب با آن مواجه میشوند، غلبه کرد.
ابعاد مشکل کمبود آهن
۳۰ تا ۵۰ درصد کم خونی در کودکان و سایر گروه ها ناشی از کمبود آهن است (سازمان بهداشت جهانی 2007). از آنجایی که ۱.۶ میلیارد نفر کم خون هستند (McLean et al. 2009)، در چند صد میلیون نفر کم خونی ناشی از فقر آهن آشکار می شود. به این ترتیب، کمبود آهن شایع ترین علت کم خونی در سراسر جهان است. کم خونی فقر آهن زیرمجموعه ای از دو میلیارد نفر در سراسر جهان را که از نظر تغذیه ای دچار کمبود آهن هستند مبتلا می کند (Viteri 1998). بنابراین، بار سلامتی ناشی از کمبود آهن ممکن است از شیوع جهانی کم خونی بیشتر شود. کم خونی در سراسر جهان به طور مساوی توزیع نمی شود، زیرا در مناطق جغرافیایی توسعه نیافته افزایش پنج برابری وجود دارد. در برخی از مناطق جهانی، شیوع کم خونی در میان کودکان خردسال بیش از ۵۰٪ است (جدول 1) و حتی در برخی مناطق به ۱۰۰٪ نزدیک می شود (Lutter 2008). در همان مناطق، ۴۰ تا ۵۰ درصد از جمعیت در تمام سنین به استثنای مردان غیر مسن کمخون هستند (McLean et al. 2009). در مقایسه، بار بیماری در کشورهای توسعه یافته بسیار کمتر است. در ایالات متحده، شیوع کم خونی در نتیجه کمبود آهن در بین تمام گروه های سنی و جنسیتی کاهش یافته است(کلارک 2008). با این حال، تقریباً ۱۰ میلیون نفر در ایالات متحده دچار کمبود آهن هستند، از جمله ۵ میلیون نفر که به کم خونی فقر آهن مبتلا هستند.
تشخیص کم خونی فقر آهن
مجموعه بالینی علائم و نشانه های این بیماری تا حد زیادی به میزان کم خونی بستگی دارد. مقادیر هموگلوبین مورد استفاده برای تعریف کم خونی بسته به سن، جنس، نژاد و اینکه آیا خون از منبع مویرگی (انگشتی) یا وریدی (فلبوتومی) نمونه برداری شده است متفاوت است (Newman 2006; Cable et al. 2011a). در غیاب آزمایش خودکار، دستگاه های قابل حمل یا تطبیق بصری رنگ هموگلوبین برای شناسایی سطح هموگلوبین در محدوده ۱ الی ۲ گرم در دسی لیتر از مقادیر مرجع، با95٪ دقت ثابت شده است (اینگرام و لوئیس 2000؛ لوئیس و امانوئل 2001). بیماران ممکن است از عملکرد ذهنی ضعیف یا عدم تحمل سرما شکایت کنند (روزنزوایگ و ولپ 1999). خستگی و تنگی نفس مرتبط با ورزش به طور منظم گزارش می شود. اگرچه نادر است، گلوسیت یا دیسفاژی ممکن است در هنگام ارائه شناسایی شود (کوک 2005؛ نواچک 2006). شناخت این ویژگیها ممکن است آزمایشهای آزمایشگاهی و درمان مناسب را آغاز کند.
کم خونی فقر آهن با برخی عواقب عصبی نسبتاً چشمگیر همراه است. برخی از افراد مجبورند اندام تحتانی خود را در حالت استراحت حرکت دهند. سندرم پای بیقرار اکنون به عنوان یک علامت برگشت پذیر کاهش سطح آهن مغز شناخته شده است که به ویژه در دوران بارداری شایع است (Vivarelli و همکاران 1976؛ گودمن و همکاران 1988). پیکا یکی دیگر از بیماری های عصبی همراه است. پیکا به عنوان اجبار در رژیم غذایی برای موادی تعریف میشود که معمولاً بدون کمبود آهن در رژیم غذایی انسانها مصرف نمیشوند. پیکا، به ویژه ژئوفاژیا(خاک خواری)، در اکثر زنان باردار آفریقایی که در مناطقی زندگی می کنند که کم خونی فقر آهن بسیار شایع است، گزارش شده است (Njiru et al. 2011). مبنای مولکولی این رفتار غیرعادی ناشناخته است. کمبود آهن همچنین باعث اختلال در عملکرد شناختی می شود. آسیب عصبی به ویژه در طول رشد مغز نوزاد مهم است. چالشهای شناختی طولانیمدت علیرغم درمان در مراحل بعدی زندگی رخ میدهد (لوزوف و همکاران 1991). بنابراین، کم خونی فقر آهن در دوران نوزادی باید به شدت درمان شود تا از احتمال بروز مشکلات شناختی جلوگیری شود.
ارزیابی آزمایشگاهی تغییرات مشخصی را در پارامترهای خون برای ذخیره سازی، حمل و نقل و استفاده از آهن نشان می دهد. هپسیدین تنظیم کننده اصلی آهن در انسان است. متأسفانه، تنوع بین آزمایشگاهی و فقدان استانداردهای کافی، پیشرفت سنجش هپسیدین در مراقبت های بالینی را خاموش کرده است (Kroot et al. 2009).
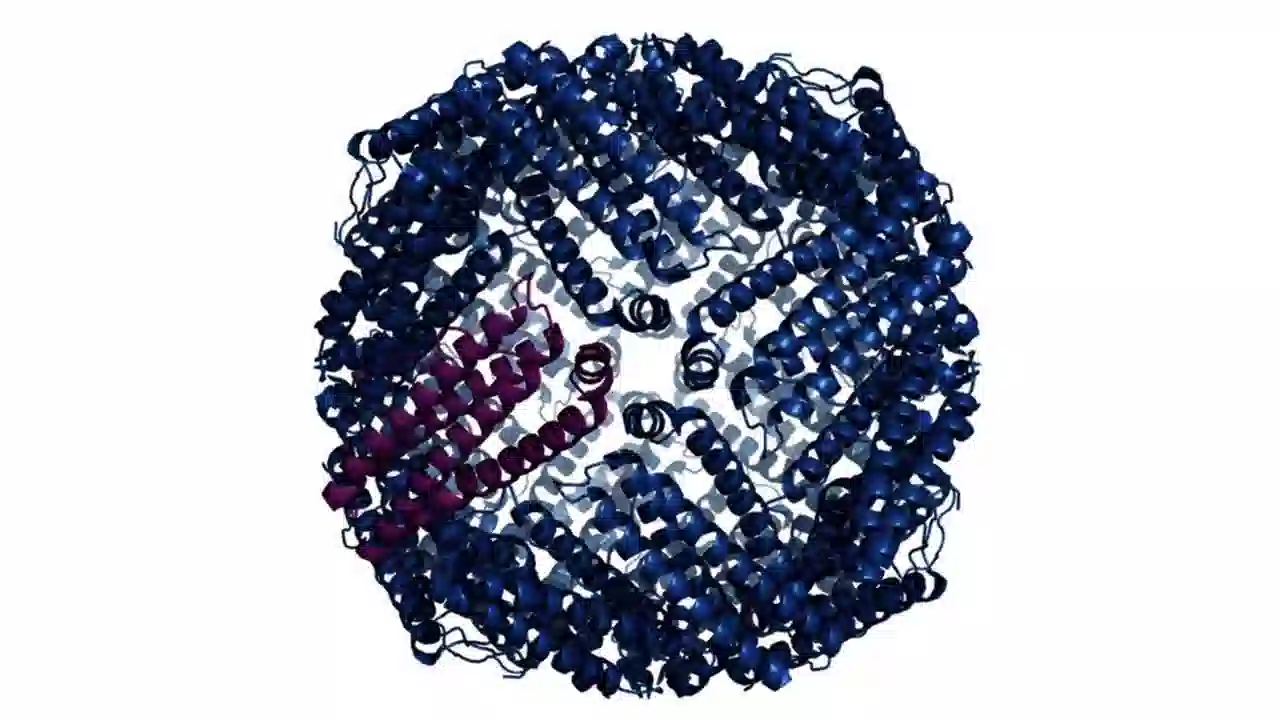
در حال حاضر، پارامتر مرکزی برای تعیین کمبود آهن و همچنین پاسخ درمانی فریتین است (Mei et al. 2005; O'Meara et al. 2011). ساختار پیچیده پروتئین فریتین به عنوان یک قفس عمل می کند تا حاوی 4500 مولکول آهن باشد (شکل 3) (Harrison and Arosio 1996). سطح فریتین سرم 15 میکروگرم در لیتر یا کمتر، تشخیصی برای کمبود آهن است و به طور خاص با عدم وجود آهن رنگپذیر مغز استخوان مرتبط است (بیکر 2000). حتی در سطوح بالاتر فریتین، ~40 میکروگرم در لیتر، ممکن است اریتروپوئزیس تحت تاثیر قرار گیرد. کمبود آهن همچنین باعث افزایش ترشح ترانسفرین محلول از اریتروبلاست ها میشود.
بنابراین، نسبتهای گیرنده ترانسفرین محلول و فریتین برای تشخیص اریتروپوئز کمبود آهن استفاده میشود (Cable et al. 2011b). هنگامی که التهاب قابل توجهی وجود دارد، سطح فریتین سرم ممکن است ذخایر دقیق آهن را منعکس نکند. در بیماران مبتلا به بیماری مزمن کلیوی، سطوح فریتین بیش از 400 میکروگرم در لیتر به طور منظم در غیاب ذخایر قابل توجه آهن مغز استخوان تشخیص داده میشود (روچا و همکاران 2009).
همانطور که انتظار میرود، سطح آهن سرم در کم خونی فقر آهن کاهش می یابد. بیان پروتئین ترانسفرین در حالت های کمبود آهن افزایش می یابد، بنابراین اشباع آهن در ترانسفرین به مقادیر کمتر از ۱۵٪ کاهش می یابد. قابل ذکر است که ترانسفرین آپوفریک و مونوفریک گونه های غالب هستند و مقادیر نسبتاً کمی از آهن دیفریک در پلاسما وجود دارد (فینچ و هوبرز 1982). کاهش آهن دیفریک به دلیل سطوح نسبی و سینتیک اشباع گیرندههای ترانسفرین روی اریتروبلاستها برای اریتروپوئزیس مناسب است (Cazzola et al. 1987). علاوه بر پارامترهای آهن، کمبود آهن اثرات قابل اندازه گیری بر گلبول های قرمز و سلول های اریتروئید دارد. محتوای کم هموگلوبین رتیکولوسیتی ناشی از کاهش تولید هموگلوبین است و ممکن است برای غربالگری نوزادان و کودکان از نظر کمبود آهن مفید باشد (Brugnara et al. 1999; Ullrich et al. 2005). با این حال، جهش های تالاسمی ممکن است تفسیر کمی هموگلوبین رتیکولوسیتی را مخدوش کند (Mast et al. 2002). کمبود آهن باعث افزایش تولید پروتوپورفیرین روی در ارتباط با کاهش تولید هم در طول بلوغ اریتروبلاست می شود. نسبت این دو پارامتر ممکن است با استفاده از گلبول های قرمز شسته شده اندازه گیری شود. اگرچه مقادیر بیش از 40 مول پروتوپورفیرین روی در هر مول هِم بیانگر وضعیت کمبود آهن است (Hastka et al. 1992)، وجود یک بیماری اخیر ممکن است حساسیت این آزمایش را کاهش دهد (Crowell et al. 2006). تظاهر کم خونی یا میکروسیتوز معمولاً نسبت به از بین رفتن ذخایر آهن بدن تا حدودی به تأخیر می افتد. روزانه حدود 1 درصد از گلبول های قرمز جایگزین می شوند و بازیافت آهن از سلول های پیر به حمایت از تولید سلول های جدید ادامه میدهد. در نهایت، در شمارش کامل خون (CBC) اثرات آن را بر گلبول قرمز منعکس خواهد کرد. ترکیبی از افزایش عرض توزیع گلبول های قرمز (RDW)، کاهش تعداد گلبول های قرمز (RBC)، کاهش هموگلوبین RBC و کاهش میانگین حجم سلول ممکن است آشکار شود،مگر اینکه کمبود آهن درمان شود.سطح هموگلوبین و هماتوکریت به سطوح پایینی کاهش می یابد که به عنوان کم خونی طبقه بندی میشود.
پاتوفیزیولوژی
کم خونی ناشی از اریتروپویزیس با کمبود آهن از طریق مکانیسم های مختلفی رخ میدهد. در کمبود آهن خالص، ذخایر آهن تخلیه شده به دلیل عدم تعادل بین جذب و استفاده از آهن است. کم خونی ممکن است در ابتدا به دلیل بازیافت آهن از گردش گلبول های قرمز وجود نداشته باشد. با این حال، کمبود آهن به تنهایی با خستگی و RLS (restless syndrome)همراه است، بنابراین بیماران ممکن است بدون کم خونی علامت دار باشند. تداوم تعادل منفی منجر به کم خونی میکروسیتیک و هیپوکرومیک میشود. پر شدن کافی منابع بدن از آهن و مدیریت علت کمبود آهن منجر به رفع کمبود آهن میشود.
در مقابل، کمبود عملکردی آهن به دلیل اختلال در آزادسازی آهن در گردش خون از انتروسیت ها، ماکروفاژها یا سلول های کبدی است. اریتروپوئزیس دارای محدودیت آهن است. در این حالت کم خونی با وجود ذخایر کافی آهن ایجاد میشود و گلبول های قرمز ممکن است نرموسیتی یا میکروسیتی به نظر برسند. این اساس کم خونی بیماری مزمن (ACD) است که در آن التهاب منجر به بیان بیش از حد هپسیدین میشود و مانع جذب آهن توسط انتروسیت ها و آزاد شدن آن از آن میشود. بنابراین، آهن خوراکی بی اثر است و آهن داخل وریدی ترجیح داده می شود. در برخی از بیماران (به عنوان مثال، مبتلایان به IBD)، ترکیبی از کمبود آهن و التهاب ممکن است منجر به کم خونی قابل توجهی شود که باید در طول درمان در نظر گرفته شود.
تشخیص
سازمان جهانی بهداشت کم خونی را به عنوان سطح هموگلوبین زیر ۱۳ گرم در دسی لیتر در بزرگسالان مرد، زیر ۱۲ گرم در دسی لیتر در بزرگسالان زن که باردار نیستند و کمتر از ۱۱ گرم در دسی لیتر در زنان باردار تعریف می کند. سطوح Hb ممکن است در سنین و نژاد مختلف متفاوت باشد. بنابراین به ویژه در تفسیر ارزش های مرزی باید مراقب بود. علاوه بر این، افراد سیگاری و ساکنان ارتفاعات بالاتر ممکن است سطح پایه Hb بالاتری داشته باشند، و شرکت در ورزش های استقامتی ممکن است سطح Hb را تغییر دهد. میانگین هموگلوبین گلبولی و میانگین حجم گلبولی ،آنمی ماکروسیتی را از کم خونی فقر آهن که هیپوکرومیک و معمولاً میکروسیتی است متمایز می کند.
کمبود مواد مغذی متعدد (مثلاً سوء جذب) یا استفاده از داروهای تیوپورین (مثلاً آزاتیوپرین در IBD) می تواند منجر به ترکیبی از کم خونی فقر آهن و ماکروسیتوز و در نتیجه کم خونی نرموسیتی شود. در این شرایط، پهنای توزیع گسترده گلبول قرمز(RDW) به شناسایی جزء کمبود آهن کمک می کند. تعداد پلاکت ها و لکوسیت ها به رد پان سیتوپنی کمک می کند. صفات تالاسمی با کم خونی میکروسیتیک و هیپوکرومیک نیز بروز میکند و باید در جمعیتهایی که این صفات در آنها شیوع بالایی دارند در نظر گرفته شود. پارامترهای دیگر برای تشخیص کمبود آهن عبارتند از: اشباع ترانسفرین (TfS)، که نشان دهنده آهن موجود برای اریتروپوئیزیس و سطح سرمی فریتین، پروتئین ذخیره آهن است. با این حال، فریتین یک پروتئین فاز حاد است که در طول التهاب افزایش می یابد. پارامترهای التهابی مانند پروتئین C-reactive به شناسایی این موقعیت ها کمک می کند. مقادیر متفاوتی در حضور بیماریهای التهابی استفاده میشود - مانند IBD (<100 نانوگرم در میلیلیتر)، CKD (<500 نانوگرم در میلیلیتر به اضافه TfS <30%) و CHF (کمتر از 100 نانوگرم در میلیلیتر یا <100-299 نانوگرم در میلی لیتر به اضافه TfS <20٪56 - برای تشخیص کمبود آهن. اگر تشخیص نامشخص باقی بماند، گیرنده ترانسفرین محلول (sTfR) و شاخص sTfR/log فریتین (<1) را می توان برای تمایز بین کم خونی فقر آهن و ACD استفاده کرد زیرا sTfR فقط در کم خونی فقر آهن افزایش می یابد.
مدیریت کم خونی فقر آهن
شواهد روشنی برای حمایت از درمان سریع در همه بیماران مبتلا به کم خونی فقر آهن وجود دارد، زیرا مشخص است که درمان کیفیت زندگی و وضعیت فیزیکی را بهبود می بخشد و همچنین خستگی و نقص های شناختی را کاهش می دهد. (RLS) و خستگی مزمن در، نشان داده شده است که درمان جایگزینی آهن در بیماری های مزمن قلبی نیز مفید است، حتی زمانی که کم خونی وجود ندارد.، بنابراین، تصمیم به درمان کمبود آهن در یک بیمار بدون کم خونی آشکار باید به صورت فردی انجام شود.
درمان کم خونی فقر آهن در بیماران مبتلا به CKD، CHF یا سرطان باید با متخصصان مربوطه انجام شود زیرا ممکن است دستورالعمل های متفاوتی اعمال شود.
آهن خوراکی
جذب آهن در روده محدود است. حداکثر میزان جذب ۱۰۰ میلی گرم آهن خوراکی ۲۰ تا ۲۵ درصد است و تنها در اواخر مرحله کمبود آهن حاصل می شود. کمبود آهن پنهان و کم خونی فقر آهن به ترتیب با میانگین نرخ جذب ۱۰% و ۱۳% مطابقت دارند، در حالی که مردان سالم ۵% و زنان سالم ۵.۶% جذب می کنند. مطالعات در مدلهای حیوانی حاکی از تشدید فعالیت بیماری و القای سرطانزایی در IBD هستند.
اگرچه دوزها معمولاً بین ۱۰۰ تا ۲۰۰ میلی گرم آهن در روز متغیر است، اما با دوزهای کم ۱۵ تا ۳۰ میلی گرم آهن در روز می توان به تکمیل موفقیت آمیز آن دست یافت.
نمک های آهن:
به عنوان مثال، سولفات آهن، گلوکونات آهن، و فومارات آهن.
مکمل آهن خوراکی زمانی موثر است که جذب روده دست نخورده باشد. با این حال، استفاده از آن باید به بیماران مبتلا به کم خونی خفیف محدود شود (Hb، 11.0-11.9 گرم در دسی لیتر در زنان غیر باردار و 11.0-12.9 گرم در دسی لیتر در مردان) زیرا پر شدن ذخایر آهن به آهستگی اتفاق می افتد. هنگامی که پر کردن سریعتر ذخایر مورد نظر است، تجویز داخل وریدی راه ارجح است. با این وجود، آهن خوراکی به راحتی در دسترس، ارزان و راحت است و آن را به یک گزینه درمانی مناسب تبدیل می کند. پاسخ به درمان باید به دقت کنترل شود. سطح هموگلوبین باید در عرض 4 تا 8 هفته 2 گرم در دسی لیتر افزایش یابد، اگرچه برخی از بیماران ممکن است پس از چند روز احساس بهبودی را گزارش کنند. اگر سطح هموگلوبین در این بازه زمانی به درستی پاسخ ندهد، درمان باید اصلاح شود (به آهن داخل وریدی تغییر یابد) و علت عدم پاسخ ارزیابی شود. بسته به شدت کمبود و علت زمینه ای، عادی سازی سطح هموگلوبین ممکن است تا 3 ماه طول بکشد و ممکن است جایگزینی ذخایر آهن (فریتین > 100 میکروگرم در لیتر) حتی بیشتر هم طول بکشد.
آهن داخل وریدی
آهن داخل وریدی در درمان کم خونی فقر آهن بسیار موثر است و باید در صورت بی اثر بودن آهن خوراکی مورد توجه قرار گیرد. اثربخشی آهن خوراکی زمانی کاهش می یابد که جذب از طریق روده مختل شود (مثلاً در بیماری سلیاک، گاستریت خودایمنی،ACD یا برداشتن معده یا دوازدهه) یا زمانی که از دست دادن آهن زیاد و/یا مداوم باشد (مانند منوراژی، خونریزی گوارشی یا پس از جراحی). کاهش پذیرش بیمار به دلیل عوارض جانبی نیز کارایی آهن خوراکی را محدود می کند. در این شرایط، درمان با آهن داخل وریدی ترجیح داده میشود. بیان فریتین در مدت کوتاهی پس از تجویز افزایش می یابد و به سطوح بالاتری نسبت به آهن خوراکی می رسد،که می تواند عود کم خونی فقر آهن را در طولانی مدت کاهش دهد.
عیب اصلی آهن وریدی، لزوم تجویز توسط متخصص بهداشت و درمان با هزینه های مربوطه است. پاسخ ایمنی در گذشته به دلیل افزایش عوارض جانبی جدی با دکستران آهن با وزن مولکولی بالا (HMWID) یک مسئله بود. با این حال، بررسی پایگاه داده سازمان غذا و داروی ایالات متحده از سال 1998 تا 2000 نشان داد که میزان تجمعی عوارض جانبی جدی برای همه فرمولاسیونهای داخل وریدی به استثنای HMWID (یعنی دکستران آهن با وزن مولکولی کم، ساکارز آهن و گلوکونات آهن) کم است. (<1:200000).
بعلاوه، مطالعه کربوکسی مالتوز آهن و HMWID اثربخشی مشابهی را با واکنش های حساسیت کمتر برای کربوکسی مالتوز آهن نشان داد. اما به دلیل خطر احتمالی واکنش های آنافیلاکتیک توصیه می شود از HMWID اجتناب شود. در ایالات متحده و اروپا، HMWID از بازار حذف شده است. یک دوز آزمایشی برای تمام ترکیبات حاوی دکستران لازم است، و اگر حساسیت به دکستران شناخته شده باشد، همچنین عاقلانه است که یک دوز آزمایشی برای ساکارز آهن و گلوکونات آهن درج شود.
دوز مورد نیاز آهن تزریقی از لحاظ تاریخی با فرمول Ganzoni محاسبه میشد، که در آن کمبود آهن کل بر حسب میلیگرم = [وزن بدن بر حسب کیلوگرم x (Hb هدف - Hb واقعی بر حسب گرم در دسیلیتر) x 0.24] + 500 با این حال، این فرمول نامناسب است. کارآزمایی FERGIcor (FERinject در اختلالات گوارشی برای اصلاح کمبود آهن) یک طرح دوز سادهتر را با دوز محاسبهشده توسط گانزونی مقایسه کرد و اثربخشی و انطباق بهتری با رژیم سادهتر پیدا کرد. مطالعه ای که در بیماران مبتلا به IBD انجام شد، می تواند به عنوان یک نقطه مرجع برای درمان عمومی مورد استفاده قرار گیرد. بیماران مبتلا به کم خونی شدیدتر (<7.0 گرم در دسی لیتر) ممکن است به 500 میلی گرم آهن اضافی نیاز داشته باشند. هنگامی که مقادیر زیادی آهن مورد نیاز است، کربوکسی مالتوز آهن و دکستران آهن با وزن مولکولی کم سودمند هستند، زیرا دوزهای بالاتر را می توان در هر انفوزیون تجویز کرد، در حالی که سایر فرمولاسیون ها (ساکارز آهن و گلوکونات آهن) نیاز به برنامه های انفوزیون متعدد با افزایش هزینه های مرتبط دارند.
تعادل آهن با اصلاح جذب روده ای بدون دفع فعال کنترل می شود. بنابراین، باید مراقب بود که در این صورت اضافه بار آهن ایجاد نشود. ارزیابی سطح فریتین باید ۸ تا ۱۲ هفته پس از پایان درمان در نظر گرفته شود. TfS بیش از ۵۰% نشانگر اضافه بار آهن است و درمان باید بر این اساس اصلاح شود. سطح هموگلوبین باید ۲ گرم در دسی لیتر در عرض ۴ تا ۸ هفته پس از جایگزینی آهن افزایش یابد. بیمارانی که به آهن داخل وریدی پاسخ نمی دهند احتمالاً ACD دارند و ممکن است علاوه بر آهن داخل وریدی، برای درمان با عوامل محرک گلبول قرمز نیز در نظر گرفته شوند. برای به حداقل رساندن عوارض جانبی، هموگلوبین باید به کمترین میزان مورد نیاز برای جلوگیری از انتقال خون افزایش یابد. هنگامی که از عوامل محرک گلبول قرمز استفاده می شود، سطح Hb هدف نباید از ۱۲ گرم در دسی لیتر تجاوز کند.
تزریق خون
در کم خونی فقر آهن مزمن باید انتقال خون بسیار محدود شود. ممکن است برای بیماران مبتلا به خونریزی فعال که از نظر همودینامیک ناپایدار هستند، یا برای بیماران مبتلا به کم خونی بحرانی (سطح هموگلوبین < 7 گرم در دسی لیتر)، ایسکمی حاد میوکارد، یا اگر تمام درمان های دیگر در اصلاح کم خونی شکست خورده اند، در نظر گرفته شود. در بیماران با بیماری قلبی عروقی قابل توجه، با مقادیر قطع بالاتر (Hb < 8 گرم در دسی لیتر) ممکن است اعمال شود. علاوه بر این، آهن داخل وریدی (و در صورت لزوم عوامل محرک گلبول قرمز) باید با هم تجویز شوند تا سطح هموگلوبین و ذخایر آهن را اصلاح و حفظ کنند و از نیاز به تزریق بعدی جلوگیری کنند.
نتایج
بر خلاف سایر کم خونی ها و هموگلوبینوپاتی های شایع، تشخیص و درمان کم خونی فقر آهن در اکثر افراد، اگر نه همه افراد، قابل دستیابی است. با این حال، در نظر گرفتن کم خونی فقر آهن باید همگرایی احتمالی چندین عامل ایجاد کننده را شامل شود. اگر منابع کافی باشد، باید مراقبت همراه با رویکردهای فردی برای درمان باشد (Alleyne et al. 2008).
در کشورهای توسعه نیافته، رویکردهای عمومی بیشتری برای غلبه بر علل همپوشانی کم خونی فقر آهن که صدها میلیون نفر را در سراسر جهان تحت تاثیر قرار می دهد، در نظر گرفته شده است. در نهایت، پیشبینی میشود که افزایش تحقیقات و درک بیولوژی بنیادی آهن به ابداع استراتژیهای جدید با هدف حذف جهانی این بیماری کمک کند.
کم خونی در جمعیت عمومی و در محیط بالینی بسیار شایع است. با کاهش کیفیت زندگی، بدتر شدن پیامد بالینی و افزایش هزینه های مراقبت های بهداشتی همراه است. کمبود آهن مقصر اصلی است و کمبود آهن به تنهایی ممکن است باعث خستگی، RLS و اختلال در عملکرد شناختی شود.
کم خونی ناشی از فقر آهن باید پس از تشخیص درمان شود و برای کمبود آهن بدون کم خونی زمانی که دارای علامت باشد درمان باید در نظر گرفته شود. متخصصان گوارش به عنوان مدیران مرکزی بیماران مبتلا به خونریزی روده یا سوء جذب آهن شناخته شده اند. آنها متخصص در روش های آندوسکوپی هستند که برای اهداف تشخیصی و درمانی انجام می شوند. آنها همچنین باید در درمان جایگزینی آهن متخصص شوند و در صورت نیاز در تجویز آهن به صورت داخل وریدی صلاحیت داشته باشند.
منابع:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3685880/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4836595/#!po=23.3333
این مقاله توسط دانشجویان پزشکی سید مصطفی زمانی و عرفان باروتچی ترجمه و صحت علمی آن تایید شده است.